Agroindustral residues represents an alternative source for obtaining fermentable products, such as glucose, with higher energy value. Therefore, in this work the isolation of a microorganism with cellulolytic capacity is carried out. A fermentation test of wheat straw with physical pretreatments (grinding), and the combination of a chemical pretreatment —using a saturated solution of Ca(OH)2— with a physical one, combining three particle sizes for the wheat straw were proposed. The results showed that the combination of particle size (141 μm ~ 250 μm) with the chemical pretreatment had a positive effect on biological consumption-degradation of 79.5% and a biomass/substrate yield of 0.49 g/g was observed. Both particle size and alkaline treatment had no significant effect on the cellulolytic activity of the obtained extract (p > 0.05).
INTRODUCCIÓN
Los residuos de biomasa forestal y agrícola son una fuente barata y renovable de biomasa lignocelulolítica con importante contenido de azúcares, que a su vez resultan una fuente de materia prima para la producción sostenible de productos químicos y biocombustibles (Singhania, Patel, Sukumaran, Larroche & Pandey, 2013). La fuente de carbono tiene un papel importante en la producción de proteínas por microorganismos y el uso de residuos agroindustriales como fuente de carbono —glucosa— es muy atractivo considerando los bajos costos (Guimarães, Somera, Terenzi, De Moraes & Jorge, 2009). La paja de trigo es la más abundante materia prima lignocelulósica en Europa y la segunda en el mundo después de la paja de arroz (Kim & Dale, 2004). Ha sido utilizada para la producción de celulasas en diversas fermentaciones: sólidas y sumergidas y diversas relaciones agua/sólido (Bansal, Tewari, Soni & Soni, 2012; Kachlishvili, Penninckx, Tsiklauri & Elisashvili, 2006; Pensupa, Jin, Archer & Du, 2013). Un paso crucial en la conversión de la biomasa en productos químicos y otros biocombustibles es la hidrólisis de la celulosa en glucosa (Tanaka, Koike, Itakura & Enoki 2009). La hidrólisis enzimática de la celulosa es llevada a cabo por un proceso en el que intervienen tres clases de enzimas: Endoglucanasas (EG, EC 3.2.1.4), Celobiohidrolasas (CBH, EC 3.2.1.91) y β-glucosidasas (BG, EC 3.2.1.21). Las EG atacan la región amorfa de la celulosa, rompen enlaces internos β-1,4 glucosídicos proporcionando enlaces externos de la cadena para la acción de las CBH que actúan sobre los enlaces extremos reducidos y no reducidos de la celulosa para liberar celobiosa principalmente soluble; por último, las EG que hidrolizan la celobiosa soluble y oligosacáridos a glucosa (Ferreira, Duarte, Ribeiro, Queiroz & Domingues, 2009; Tao, Zhu & Huang, 2010; Zhang & Lynd, 2004). Del mismo modo, la hemicelulosa, cuyo principal carbohidrato es el Xilano, es degradada por diferentes enzimas xilanolíticas, su degradación total requiere la acción cooperativa de endo-1,4-β-xilanasa (EC 3.2.1.8) y xilano 1,4-β-xilosidasa (EC 3.2.1.37) (Sánchez, 2009). El rendimiento de azúcares provenientes de la hidrólisis enzimática de materiales celulósicos se ve favorecido por los diferentes métodos de pretratamiento entre las que figuran: físico —trituración, irradiación, hidrotérmico—, químico —ácidos, álcalis, solventes, agentes oxidantes— y biológico —hongos y actinobacterias—. El tratamiento físico —como la molienda— mejora la susceptibilidad a la hidrólisis enzimática mediante la reducción del tamaño de los materiales y el grado de cristalinidad de la lignocelulosa lo que incrementa la eficiencia de la hidrólisis enzimática que a su vez resulta en un proceso ambientalmente amigable (Alvira, Tomás-Pejó, Ballesteros & Negro, 2010; Hideno et al., 2009; Sasaki et al., 2015). La combinación de algunos de ellos disminuyen notablemente el grado de cristalinidad, incrementando el rendimiento de celulosa a azúcares reductores: como tratamiento alcalino con microondas (Singh, Bajar & Bishnoi, 2014), molienda con tratamiento hidrotérmico (Sasaki et al., 2015), reducción mecánica con soluciones ácidas o alcalinas (Zhu, Xin, Chang, Zhao & Weichong, 2015) y recientemente disolventes eutécticos derivados de componentes naturales (Zhang, Benoit, De Oliveira, Barrault & Jérôme, 2012) en combinación con tratamiento físico (Gunny, Arbain, Nashef & Jamal, 2015). La cal —Ca(OH)2— utilizada en solución alcalina como pretratamiento presenta varias ventajas, es barata, fácil de manejar y recuperar (Chang, Nagwani & Holtzapple, 1998), se ha utilizado como pretratamiento para la hidrólisis enzimática de la paja de maíz (Kaar & Holtzapple, 2000), y la digestibilidad del bagazo de agave (Ramírez-Cortina, Alonso-Gutiérrez & Rigal, 2012). El hidróxido de calcio, junto con un agente oxidante como el aire u O2, se mezcla con la biomasa a temperaturas que van desde los 40 °C hasta los 150 °C para un período que va de horas a semanas. El efecto principal es la eliminación de la lignina y grupos acetilo de la biomasa, lo cual mejora la reactividad de los polisacáridos restantes (Balat, Balat & Öz, 2008). Los microorganismos degradadores de celulosa incluyen diferentes grupos de hongos, actinomicetos y bacterias; sin embargo, solo un pequeño grupo de microorganismos, entre los cuales figuran los hongos filamentosos como Trichoderma reesei, Aspergillus niger, Aspergillus nidulans y, recientemente, Neurospora crassa, poseen la capacidad de degradarla completamente (Gutiérrez-Rojas, Moreno-Sarmiento & Montoya, 2015) y otros con propiedades lignocelulolíticas como Streptomyces thermocerradoensis y Staphylococcus pasteuri (Bazán-Lugo, Salinas, Álvarez & Silva, 2014; Brito-Cunha, Gama, Jesuino & Faria, 2015). Entre las bacterias —que presentan mayor rapidez de crecimiento en comparación con los hongos— con cualidades celulolíticas se encuentra el grupo de Pseudomonas spp., las cuales están ampliamente distribuidas en el suelo (Bakare, Adewale, Ajayi & Shonukan, 2005; Hall et al., 1995; Nakamura & Kitamura, 1982) y pueden encontrarse como unicelulares en forma de barra recta o curva, en pares o formando cadenas; con una longitud que va de 0.5 μm a 0.8 μm por 1.5 μm a 3 μm, tienen flagelos solitarios o periféricos y son Gram negativas (Chen, 2014; Todar, 2008). El objetivo de este trabajo fue realizar el seguimiento de la degradación biológica de la celulosa con pretratamiento físico (molienda) y químico (Ca(OH)2) mediante el empleo de un microorganismo celulolítico, determinar el rendimiento observado Y´x/s por medio de un balance de masa y la obtención de un extracto con actividad celulolítica.
MATERIALES Y MÉTODOS
Aislamiento del microorganismo
El microorganismo se aisló de una composta en fase de maduración elaborada a partir de desechos de la poda de pastos y desperdicios de comida provenientes de las áreas respectivas de la Universidad Tecnológica de Tecámac, se tomó aproximadamente 50 g de material orgánico a una profundidad de 30 cm y se colocó en una bolsa de plástico estéril. La muestra se homogenizó y se tomó 1 g para incubarla a una temperatura de 39 °C ± 1.0 °C en solución isotónica durante 24 h. Después del periodo de incubación se sembró por estriado masivo sobre una placa estéril con medio Luria Bertani (LB) sólido: peptona, 5 g/l, extracto de levadura, 0.3 g/l, celulosa 3 g/l y agar, 15 g/l. Se incubó nuevamente bajo las mismas condiciones y se tomó una azada de la colonia predominante. Se repitió el resembrado hasta obtener una colonia pura.
Identificación bioquímica del microorganismo
La cepa se propagó en medio Agar Soja y Tripticaseina (TSA) y se incubó a 37 ºC durante 48 h. La identificación bioquímica del género y especie del microorganismo se realizó mediante el sistema automatizado VITEK 2 de bioMÉRIEUX® USA de acuerdo a las especificaciones del fabricante.
La cepa aislada se propagó en un medio con la siguiente composición: 3 g/l celulosa, 5 g/l peptona, 3 g/l extracto de levadura, 1 g/l NaCl, 1 g/l MgSO4, 1 g/l K2HPO4 y 0.01 g/l FeSO4 ·7H2O y se incubó durante 72 h a 35 ºC.
Pretratamiento de la paja de trigo
La paja de trigo se lavó con abundante agua y se secó en un horno durante 72 h a 90 ˚C (± 5 ˚C). Posterior al secado, se molió con una licuadora de una velocidad marca OSTERIZER® modelo 450 - 10 (400 Watts). La harina obtenida fue pretratada de acuerdo a Kim & Holtzapple (2005); combinando una relación de 0.5 g de Ca(OH)2/g de harina de paja y 5 g de agua/g de harina de paja de trigo durante 4 semanas a una temperatura de 55 °C con aireación. Posteriormente, se lavó con abundante agua hasta alcanzar un pH cercano a 7 (± 0.5) y se secó bajo las mismas condiciones antes descritas. Se clasificaron las harinas en tres tamaños de partícula en tamices dispuestos en cascada como sigue: “1” retenidas entre mallas 100 y 60 (141 μm ~ 250 μm); “2” retenidas entre mallas 60 y 42 (250 μm ~ 354 μm) y “3” retenidas entre mallas 42 y 20 (354 μm ~ 841 μm). Se mantuvieron en refrigeración a 4 ˚C hasta su uso.
Ensayos
Se realizaron 6 diferentes combinaciones con duplicado con un volumen de 300 ml de medio de cultivo en matraces Erlenmeyer con capacidad de 500 ml como sigue: para el tamaño de partícula de la paja 1, 2 y 3; con pretratamiento alcalino (A) y sin pretratamiento alcalino (B). Quedando de la siguiente manera: 1A, 1B, 2A, 2B, 3A y 3B. La composición nutricional de todos los medios fue igual que la del inóculo, remplazando la adición de 10 g/l de paja por la celulosa de acuerdo a cada ensayo y se ajustaron a un pH de 6.5. Todos los medios fueron esterilizados a 120 °C por 20 min, posteriormente se inoculó con 1 ml cada ensayo. Los matraces se incubaron a 35 °C en una incubadora de agitación orbital a 90 rpm durante 14 días.
Obtención del extracto con actividad celulolítica y balance de sólidos
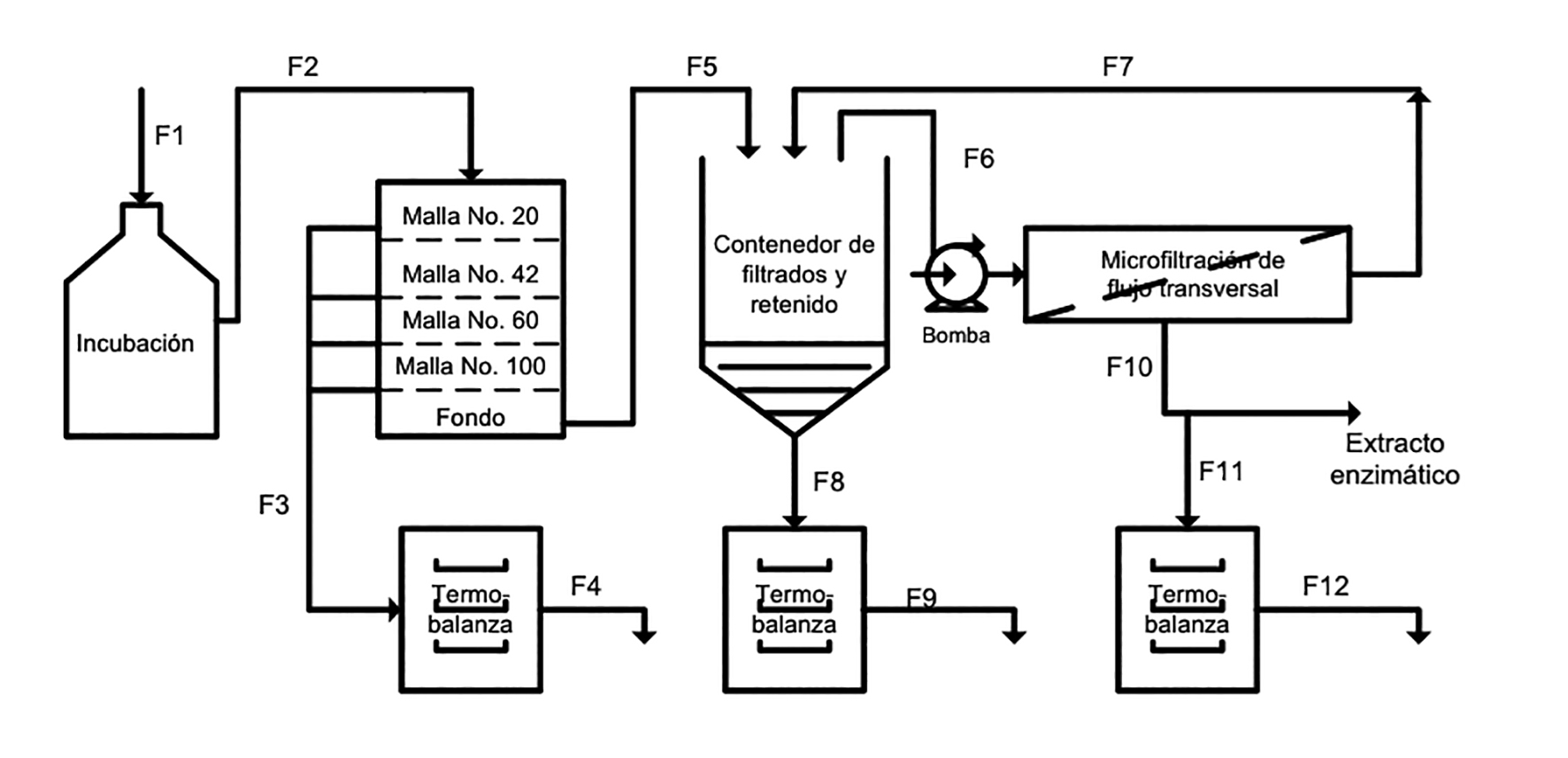
Una vez terminado el tiempo de incubación de los ensayos, se procedió a obtener el extracto enzimático, la biomasa formada y el balance de sólidos consumidos y degradados. Esto se realizó de acuerdo a la figura 1. Cada tratamiento se filtró según su tamaño de partícula inicial con el correspondiente número de tamiz (Tayler No. 20, 42, 60 y 100). Los lodos obtenidos se consideraron para el balance de sustrato no degradado. El filtrado se colocó en un contenedor para fluir a través de una micromembrana de flujo transversal de fibra hueca de poliestersulfona, FiberFlow MINNTECH®, con tamaño de poro de 0.1 µm. El retenido se recirculó y mezcló con el filtrado hasta obtener el 10% del volumen inicial, el permeado se consideró como extracto con actividad celulolítica. Tanto a los lodos, el retenido y el permeado se les determinó el porcentaje de sólidos considerándolos como sustrato no degradado, biomasa y sólidos solubles degradados respectivamente por medio de una termobalanza (Sartorius, modelo Mark III). Los sólidos no degradados y degradados se contemplaron como consumo-degradación de sustrato.
|
|
|
 |
|
|
Diagrama de flujo para la obtención del extracto con actividad celulolítica y balance de materia
F1: Alimentación; F2: Caldo de fermentación; F3: Lodos; F4: Sólidos no degradados secos; F5: Líquido clarificado; F6: Alimentación a microfiltrón; F7: Recirculación del retenido; F8: Retenido; F9: Biomasa seca; F10: Permeado; F11: Secado de productos y sustrado degradados; F12: Sólidos.
Fuente: Elaboración propia.
|
 |
Diagrama de flujo para la obtención del extracto con actividad celulolítica y balance de materia
F1: Alimentación; F2: Caldo de fermentación; F3: Lodos; F4: Sólidos no degradados secos; F5: Líquido clarificado; F6: Alimentación a microfiltrón; F7: Recirculación del retenido; F8: Retenido; F9: Biomasa seca; F10: Permeado; F11: Secado de productos y sustrado degradados; F12: Sólidos.
Fuente: Elaboración propia. Close |
Rendimiento de biomasa
El rendimiento de la biomasa formada se calculó conforme a la siguiente ecuación:
(1)
Donde: ∆X es la biomasa producida, S el sustrato (paja de trigo), ∆ST la masa total de S consumido, ∆SC la masa total de S consumido y ∆SD sustrato degradado no consumido y utilizado en otros productos no relacionados con el crecimiento (Doran, 1995).
Las variables de la ecuación 1 se calcularon mediante un balance de materia de acuerdo a la figura 1 como sigue:
(2)
(3)
(4)
Realizando un balance total para S consumido
(5)
donde: χST, χB, χC y χD son las fracciones másicas para: el sustrato total, la biomasa, sólidos consumidos y sólidos degradados no consumidos, respectivamente.
Combinando las ecuaciones (2) y (5) en (1) se obtuvo la ecuación para el balance del rendimiento de la biomasa observada:
(6)
Ensayo de la actividad celulolítica del extracto
La actividad celulolítica del extracto se evaluó por medio del método de Miller (1959); empleando ácido 3,5-dinitrisalicílico (DNS) para la determinación de azúcares reductores liberados provenientes de la celulosa. La actividad de la celulasa se determinó de acuerdo a Adney & Baker (1996), realizando dos diluciones distintas para el extracto obtenido mediante microfiltración de cada ensayo, un blanco y un control. Se mezclaron 0.5 ml de una dilución de extracto enzimático crudo con 1.0 ml de buffer de citrato de sodio (0.05 M, pH 4.8) en cada tubo de ensayo que contenía una tira de papel filtro Whatman No. 1.0 con dimensiones de 1.0 cm × 6.0 cm —aproximada de 50 mg—. Se incubaron a 50 ˚C durante una hora, deteniendo la reacción enzimática por medio de la adición de 3 mL de DNS y se colocaron en baño María a ebullición durante 5 min y se transfirieron a un recipiente con hielo. Se determinó la absorbancia a 540 nm. A partir de una curva estándar se evaluó la concentración de enzima que libera 2 mg de glucosa. La actividad celulolítica del extracto se determinó a partir de la actividad de papel de filtro (FPU/ml) y se calculó utilizando la siguiente ecuación (Adney & Baker, 1996):
206 (7)
Un FPU se definió como la cantidad de enzima que libera 1 μmol de equivalentes de glucosa por minuto bajo las condiciones de ensayo.
Análisis estadístico
Todos los ensayos y parámetros evaluados para la formación de biomasa, consumo-degradación biológica de sustrato y actividad celulolítica del extracto se realizaron por duplicado, las diferencias significativitas entre las medias aritméticas obtenidas entre los distintos ensayos para la actividad celulolítica del extracto obtenido se realizó por medio de la prueba de comparación de medias de Duncan (α=0.05). El análisis de varianza (ANAVA) se llevó a cabo con el software estadístico Statistical Analysis System (SAS), se consideraron con diferencias significativas aquellas con probabilidad (p < 0.05). Para evaluar los efectos principales de los factores y su interacción, se propuso un diseño factorial 22 tomando las combinaciones de los ensayos en sus niveles alto y bajo; siendo el nivel alto para el tamaño de partícula menor y bajo para el mayor, las muestras pretratadas con tratamiento alcalino se consideraron como nivel alto y sin tratamiento como nivel bajo (-).
RESULTADOS
Identificación del microorganismo
El microorganismo aislado tuvo un crecimiento en medio sólido en colonias redondas, lisas y color crema, positivo a la prueba de tinción de Gram y catalasa, con morfología de bacilo alargado al ser observado al microscopio con objetivo de 100X. De acuerdo a las pruebas bioquímicas realizadas al microorganismo por medio del equipo VITEK 2 se identificó con una probabilidad del 98% como una bacteria correspondiente a Pseudomonas aeruginosa.
Degradación-consumo biológica de sustrato
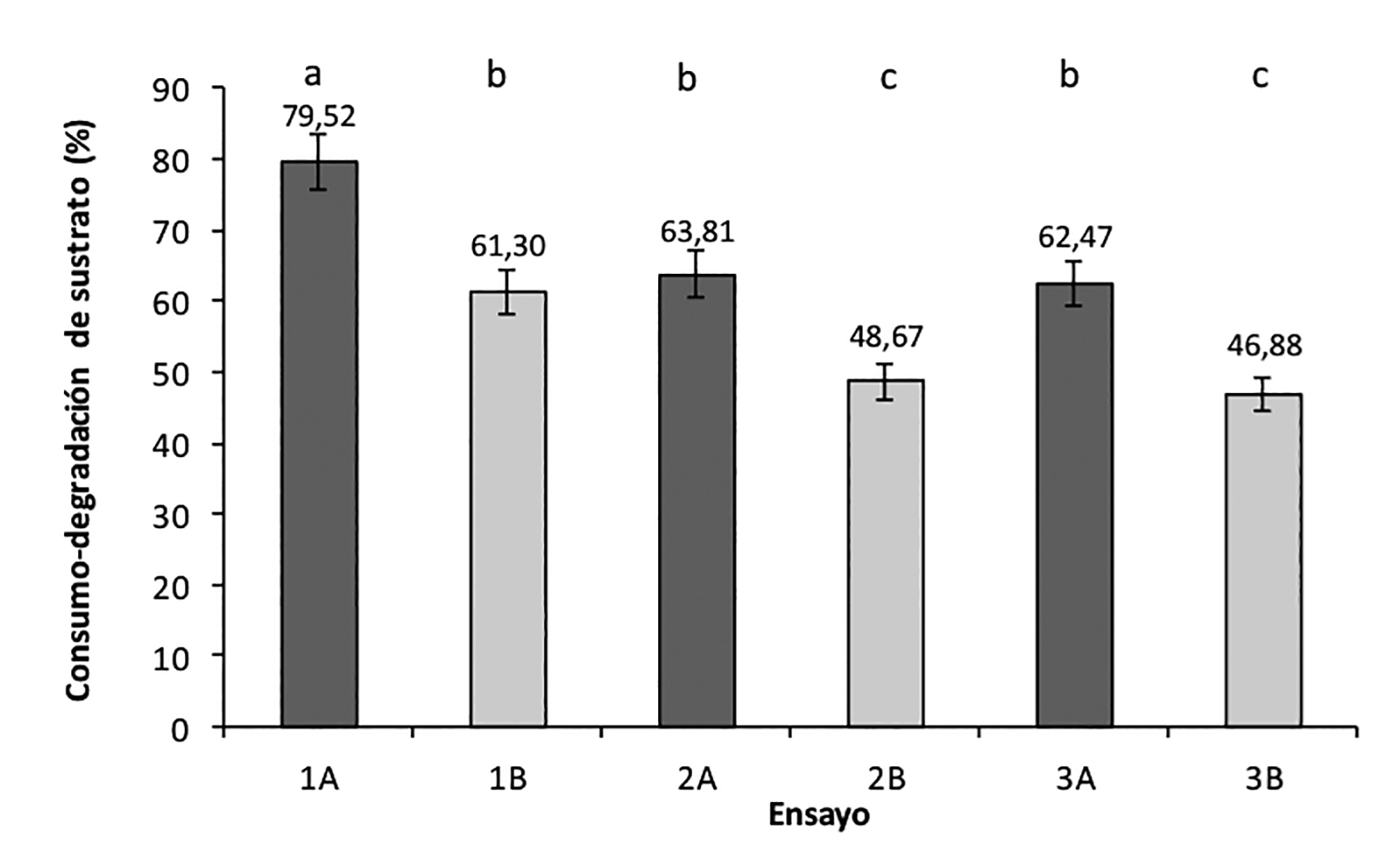
La degradación-consumo de sustrato (paja de trigo) por parte de la actividad biológica de Pseudomonas earuginosa presentó diferencias significativas entre los distintos ensayos (p < 0001). La combinación del pretratamiento químico con pretratamiento físico en menor tamaño de partícula (250 μm ~ 141 μm) presentó el mayor valor para este parámetro (figura 2). El pretratamiento físico con menor tamaño de partícula (1B) resultó significativamente mayor sobre el consumo-degradación de sustrato que los pretratamientos con mayor tamaño de partícula (2B y 3B), y a su vez no observó diferencias significativas con los ensayos 2A y 3A llevados en combinación con pretratamiento alcalino-molienda con mayor tamaño de partícula (250 μm ~ 841 μm). En condiciones similares, Zeng, Mosier, Huang, Sherman & Ladisch (2007) encontró que tamaños de partículas de entre 75 μm presentan efecto diferente con aquellos con tamaños de partícula próximos a 710 μm sobre la digestibilidad enzimática en paja de maíz. La comparación de los ensayos 2B y 3B mostró que el pretratamiento físico con tamaño de partícula 354 μm ~ 250 μm y 250 μm ~ 141 μm sin tratamiento químico no observaron diferencias significativas entre sí (p > 0.05), esto corresponde por lo reportado por Kaar & Holtzapple (2000), quienes encontraron que tamaños de partículas relativamente grandes de harina de paja de maíz no tienen efecto sobre su cristalinidad e hidrólisis enzimática. De acuerdo al análisis estadístico factorial, tanto el tamaño de partícula como el tratamiento alcalino afectaron de manera significativa (p < 0.05) la degradación-consumo biológica de la paja pretratada en sus distintas combinaciones.
|
|
|
 |
|
|
Figura 2. Gráfica de la degradación-consumo biológica de sustrato.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia
|
 |
Figura 2. Gráfica de la degradación-consumo biológica de sustrato.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia Close |
Formación de biomasa
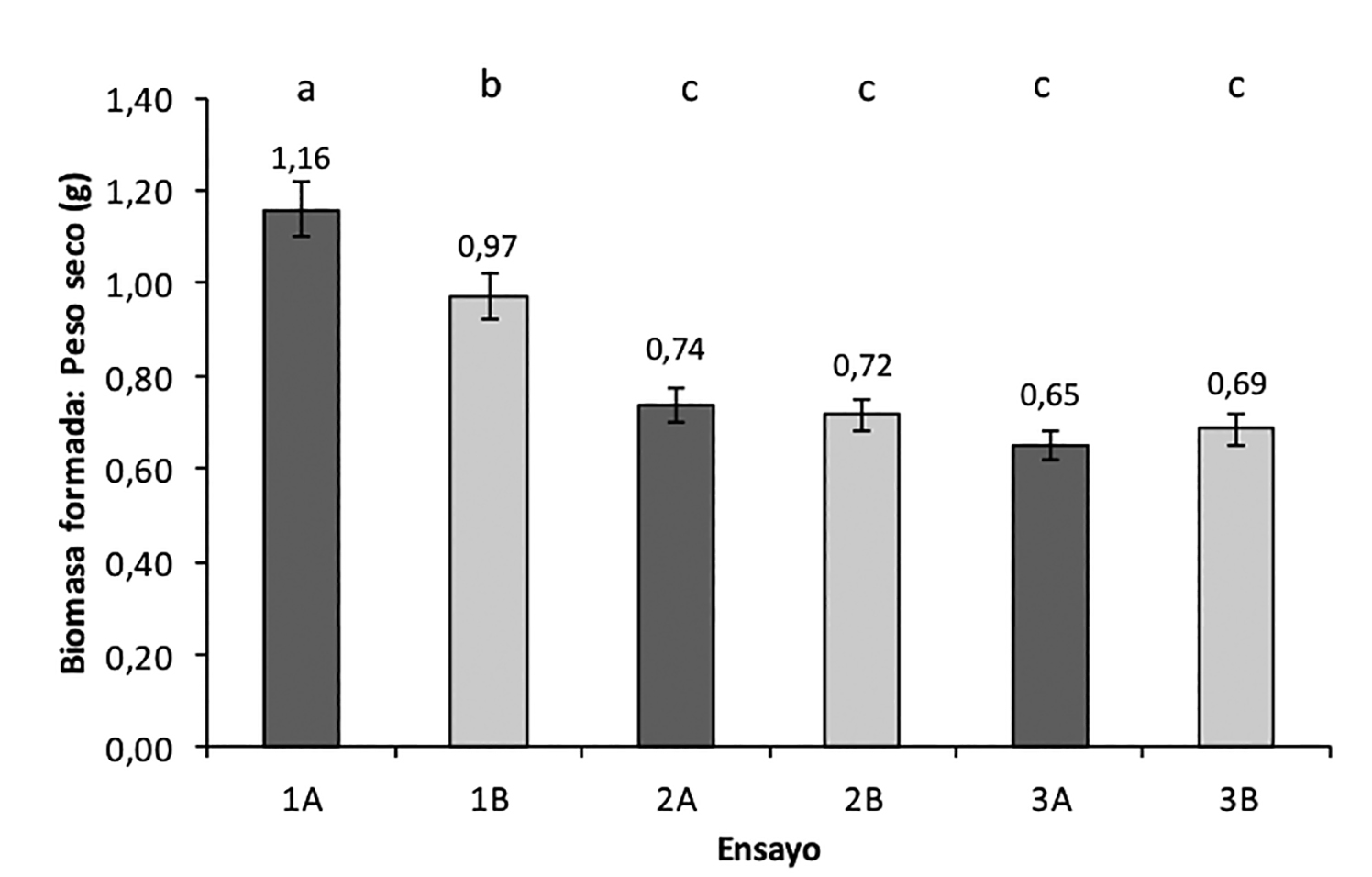
Los diferentes ensayos tuvieron efecto marcado (p = 0.0029) sobre la formación de biomasa. De acuerdo a la figura 3, la deslignificación y la hidrólisis de los polisacáridos glucano y xilano provocado por el tratamiento alcalino (Kim & Holtzapple, 2005) en combinación con el menor tamaño de partícula (ensayo 1A) resultó de manera positiva y significante. La comparación de medias para la biomasa formada entre los ensayos sin tratamiento alcalino, mostraron que el mayor valor obtenido fue para el ensayo con menor tamaño de partícula (141 μm ~ 250 μm), esto se corrobora con lo observado por Sasaki et al. (2015), quienes reportaron que la molienda mecánica incrementa la transferencia de masa. El análisis factorial mostró que el tamaño de partícula con o sin pretratamiento alcalino no tuvo efecto significativo (p > 0.05) sobre la biomasa formada; mientras que el mayor efecto sobre esta respuesta fue debido al pretratamiento con Ca(OH)2.
|
|
|
 |
|
|
Figura 3. Gráfica de peso seco de la biomasa obtenida para cada ensayo.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia
|
 |
Figura 3. Gráfica de peso seco de la biomasa obtenida para cada ensayo.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia Close |
Rendimiento observado (Y´xs)
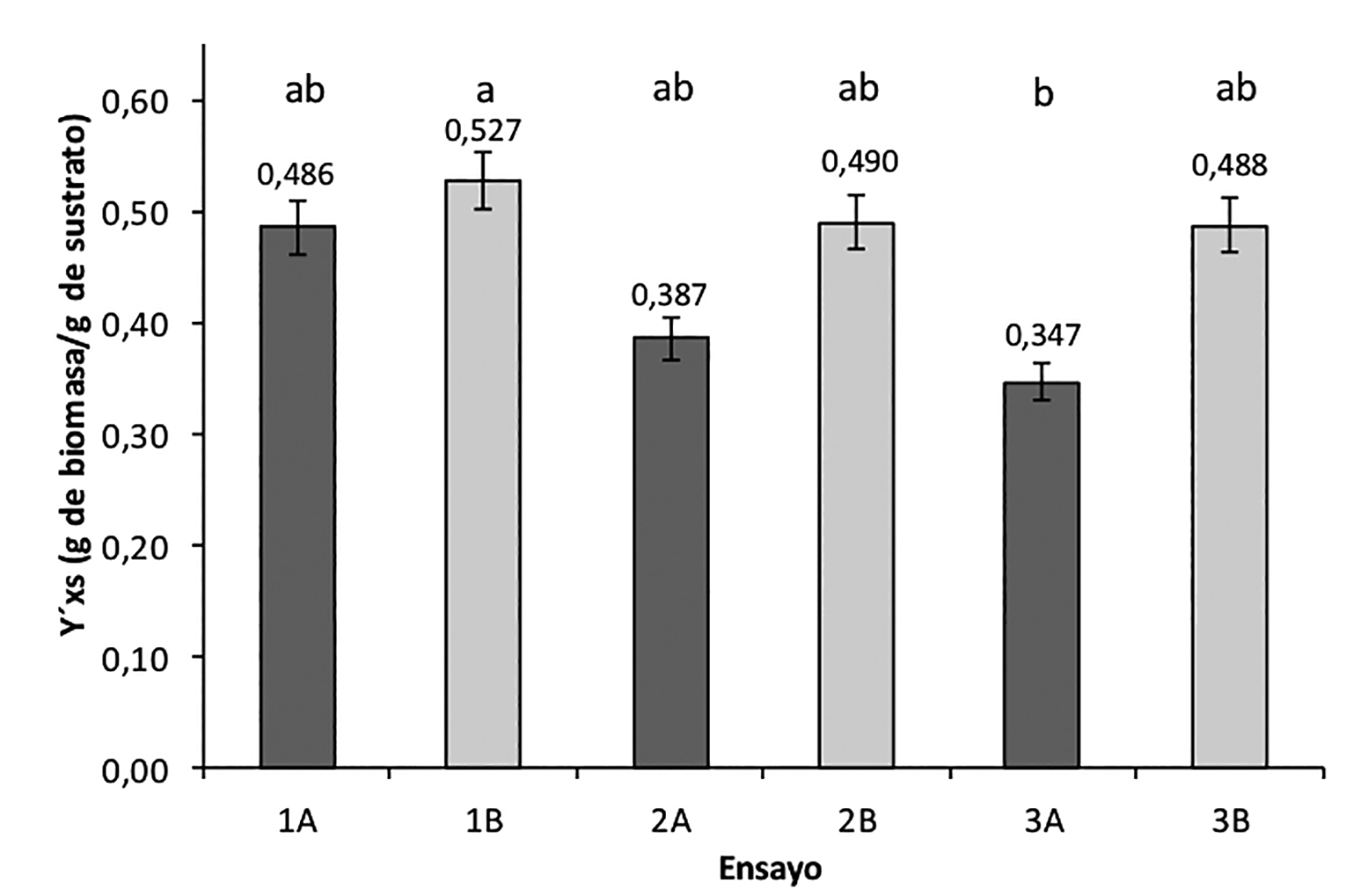
El análisis de las medias obtenidas para el rendimiento (figura 4) mediante el estadístico de Duncan (α = 0.05) mostró que el ensayo 1B, con reducción mecánica de partícula (145 μm ~ 250 μm) como único pretratamiento resulto ser significativamente mayor sobre este parámetro, mientras que el ensayo 3A con reducción mecánica de tamaño entre 354 μm y 841 μm en combinación con pretratamiento químico, resultó ser significativamente menor sobre el rendimiento de biomasa observado. La reducción mecánica de tamaño entre 250 μm - 841 μm sin tratamiento químico (2B y 3B), así como el ensayo 1A con menor tamaño de partícula (145 μm ~ 250 μm) en combinación con tratamiento químico no exhibieron diferencias significativas entre ellos (p > 0.05). Los ensayos con molienda de la paja de trigo como único pretratamiento (1B, 2B y 3B) presentaron mayor rendimiento de biomasa en comparación con aquellos que tuvieron una combinación de pretratamiento físico y químico (1A, 2A y 3A), esto corresponde con el menor grado de consumo y degradación de la paja de trigo (figura 2). El mismo efecto, estadísticamente significativo, sobre el rendimiento de biomasa presentaron el pretratamiento físico y químico (p = 0.02), en sus distintos niveles sin interacción entre ellos (p = 0.10).
|
|
|
 |
|
|
Figura 4. Gráfica de rendimiento de la biomasa a partit del sustrato.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia
|
 |
Figura 4. Gráfica de rendimiento de la biomasa a partit del sustrato.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia Close |
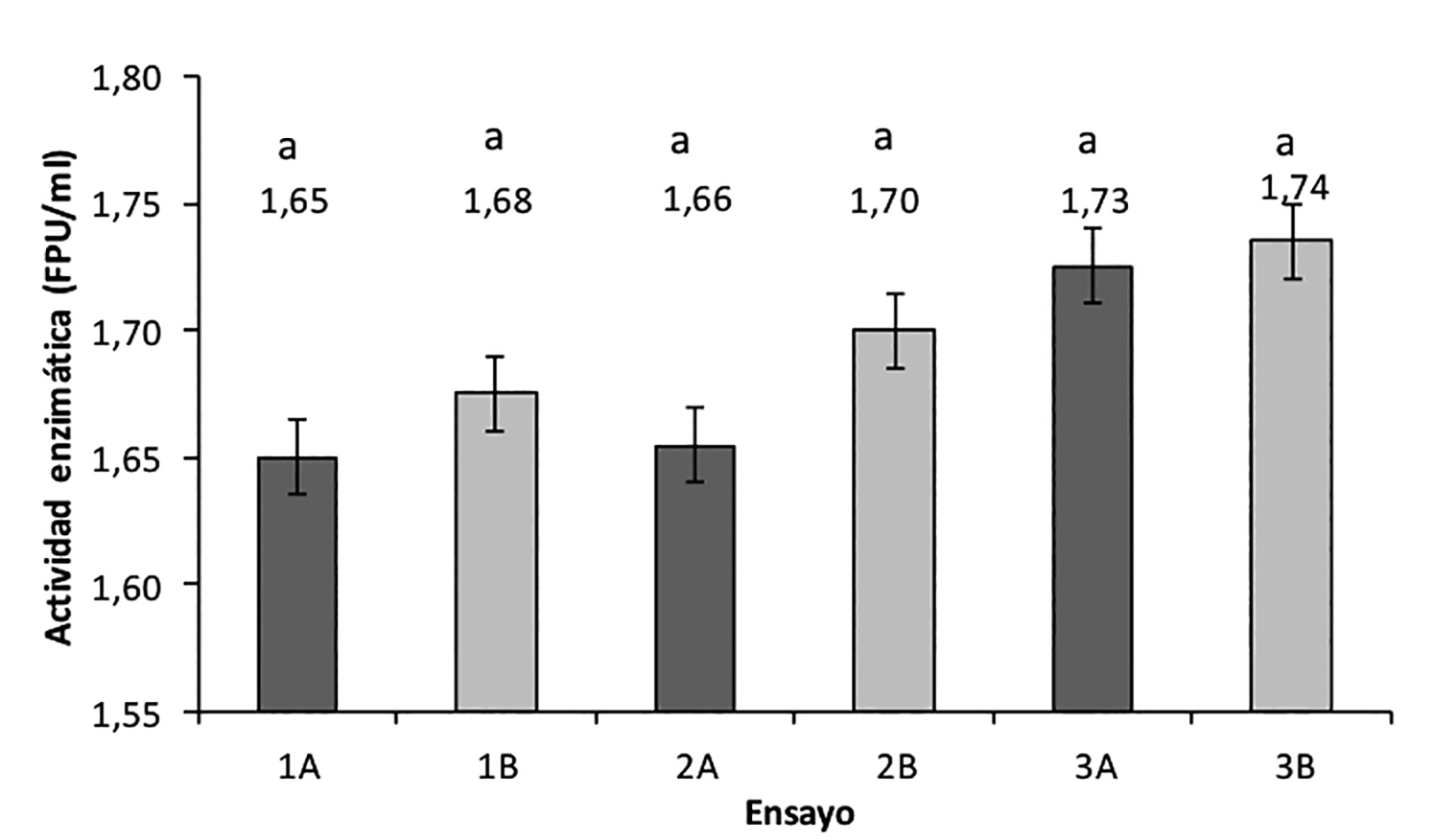
Determinación de la actividad celulolítica del extracto
En la figura 5 se presenta la gráfica de las medias obtenidas para los diferentes ensayos del extracto celulolítico (obtenido a los 14 días de fermentación) sobre la hidrólisis de papel filtro medido a partir de la cantidad de glucosa liberada (FPU/ml). El análisis de varianza con un nivel de confianza del 95% mostró que los pretratamientos físico (molienda), químico —Ca(OH)2— y su combinación no exhibieron efecto significativo (p = 0.207) sobre la actividad celulolítica del extracto obtenido a partir de cada ensayo. Lo anterior también se pudo comprobar mediante el análisis de medias, donde ninguna media obtenida resultó ser significativamente diferente entre sí. El análisis para la respuesta de los pretratamientos, mostraron que no hay interacción (p > 0.05) y sus efectos en sus distintos niveles no fueron estadísticamente significativos (p > 0.05).
|
|
|
 |
|
|
Figura 5. Gráfica de la actividad celulolítica (FPU) del extracto.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia
|
 |
Figura 5. Gráfica de la actividad celulolítica (FPU) del extracto.
Medias con la misma letra no son significativamente diferentes entre si (p < 0.05)
Fuente: Elaboración propia Close |
De acuerdo a Tolonen et al. (2015), la mayor degradación-consumo de paja de trigo efectuado para los ensayos con pretratamiento químico y/o físico (figura 2) se debe principalmente al pretratamiento y no a la actividad celulolítica del extracto enzimático.
CONCLUSIONES
Se encontró que los pretratamientos combinados con cal y molienda de la paja de trigo resultaron en un consumo-degradación biológica por parte de Pseudomonas aeruginosa más significante sobre la paja de trigo en comparación con la paja con molienda como único pretratamiento; lo anterior se vio más afectado por el pretratamiento químico y/o físico aplicado que por la actividad celulolítica del extracto reportada para cada ensayo. La comparación de medias obtenidas sobre la actividad celulolítica del extracto obtenido mediante un proceso físico de los distintos ensayos pretratados con cal como pretratamiento químico en combinación con pretratamiento físico (molienda) con tamaños de partícula de 141 μm ~ 250 μm, 250 μm ~ 354 μm y 354 μm ~ 841 μm no resultaron con diferencias significativas entre sí. El efecto principal del pretratamiento de la paja trigo sobre las respuestas estudiadas, se presentó sobre el consumo-degradación biológica de la paja de trigo.