RESUMEN
La diabetes es una enfermedad metabólica caracterizada por hiperglucemia y resistencia a la insulina. La curcumina, potencial agente antidiabético, regula la expresión génica y diferentes vías de señalización. El objetivo es determinar el efecto de la curcumina sobre la expresión de proliferador peroxisomal gamma (PGC)-1α, proliferador de peroxisomas gamma (PPARγ) y factor de necrosis tumoral alfa (TNF)-α en corazón de ratón diabético db/db. Para ello, se utilizaron tres grupos de ratones (n = 3): silvestres (WT), diabéticos (db/db) y diabéticos tratados con curcumina (db/db+C). La curcumina (0.75%) se administró en la dieta durante ocho semanas. La expresión de las proteínas se determinó por Western blot. Como resultado, la curcumina previno la súbita pérdida de peso en los ratones db/db, pero no tuvo efecto sobre los niveles de glucosa sanguínea. La curcumina incrementó la expresión de PPARγ y disminuyó la expresión de TNF-α en los ratones diabéticos, pero no modificó la expresión de PGC-1α. Se concluye que la curcumina regula la expresión de PPARγ, factor nuclear kappa de los infocitos B (NF-κB), pero no la de PGC-1α.
ABSTRACT
Diabetes is a metabolic disease characterized by hyperglycemia and insulin resistance. Curcumin is a potential antidiabetic agent which regulates gene expression and different signaling pathways. This study aims to determine the effect of curcumin on PGC-1α, PPARγ and TNF-α expression in heart of db/db diabetic mice. To this end, three groups of mice (n = 3) were used: WT, db/db and db/db+C. Curcumin (0.75%) was administered in their diet for 8 weeks. Protein expression was determined by Western blot. Curcumin prevented the sudden weight loss in db/db mice, but did not show effect on the blood glucose levels. Curcumin increased PPARγ and diminished TNF-γ protein in db/db mice, but did not alter the expression of PGC-1α. Curcumin regulates expression of PPARγ and TNF-α, but not of PGC-1α.
INTRODUCCIÓN
México ocupa el segundo lugar de mayor prevalencia de obesidad, con 22 millones de personas (30% de la población adulta) (Barrera-Cruz, Rodríguez-González & Molina-Ayala, 2013). Esto es un factor clave para el desarrollo de la diabetes mellitus tipo 2 (DM2) (Xu et al., 2003). Actualmente, México se sitúa dentro de los primeros diez países con mayor prevalencia de DM2. Después de los 55 años de edad, uno de cada tres mexicanos es diagnosticado con DM2, de los cuales 55% son mujeres y 45% son hombres (Folli et al., 2011). La DM2 se caracteriza por un estado de hiperglucemia progresiva y resistencia a la insulina. La hiperglucemia crónica desarrolla graves complicaciones en diferentes órganos y tejidos, entre ellos el corazón (Al-Mukhtar, Fadhil & Hanna, 2012). La hiperglucemia produce disfunción endotelial y activación de proteína cinasa C (PKC) con aumento en la síntesis de endotelina, y conduce a la glucosilación no enzimática de las proteínas, con efecto dañino sobre el endotelio vascular. Esto da lugar a la angina de pecho, infarto agudo al miocardio (IAM), miocardiopatía diabética y claudicación intermitente (Schuster, 2010). El riesgo de un IAM en pacientes con DM2 es igual al de alguien que ya ha tenido uno, aunque si se controla la glucemia se puede reducir el riesgo de muerte, insuficiencia cardiaca y otras complicaciones de la DM2. La obesidad y la DM2 están asociadas con un estadio de inflamación crónica de bajo grado. Existe evidencia de que la obesidad, la hiperglucemia y la sobreproducción de citocinas pro-inflamatorias como la interleucina 6 (IL-6) y el factor de necrosis tumoral alfa (TNF-α) activan el factor nuclear kappa de los linfocitos B (NF-κB). A su vez, NF-κB desregula la actividad de otras vías de señalización metabólicas donde participa la Sirtuina 1 (SIRT1) y la proteína cinasa activada por AMP (AMPK), proteínas reguladoras de ciertas rutas intracelulares, como la captación de glucosa en el músculo esquelético y la oxidación hepática de los ácidos grasos a través de la activación del coactivador 1-alfa del proliferador peroxisomal gamma (PGC-1α) (Oakhill, Scott & Kemp, 2012). El receptor activado por el proliferador de peroxisomas gamma (PPARγ) participa en el proceso de diferenciación de los adipocitos, regula el metabolismo de los lípidos y la glucosa en músculo, corazón, tejido adiposo e hígado (Picard & Auwerx, 2002), también es reconocido como un blanco molecular en el tratamiento de la DM2 por todos los medicamentos que aumentan la sensibilidad a la insulina (Moller, 2001). A pesar de que es posible el control de la glucosa mediante ejercicio y dieta, y que existen fármacos para el tratamiento de la DM2, esta enfermedad y sus complicaciones siguen siendo un problema grave de salud en todo el mundo. Por ello, es deseable el uso de tratamientos alternativos de bajo costo y con menos efectos secundarios para los pacientes. La curcumina, un componente activo de la Curcuma longa, ha sido utilizada durante siglos por habitantes de India, principalmente como un condimento. Sin embargo, se han descrito varias propiedades farmacológicas debido a que tiene efectos antioxidantes, antiinflamatorios e hipoglucemiantes (Gupta, Patchva, Koh & Aggarwal, 2012). Diversos estudios en modelos animales y en humanos han reportado sus múltiples beneficios al organismo (Franco-Robles et al., 2014; Jiménez-Flores, López-Briones, Macías-Cervantes, Ramírez-Emiliano & Pérez-Vázquez, 2014; Zhang, Fu, Gao & Liu, 2013), pero el mecanismo no está completamente claro. Se ha sugerido que la curcumina tiene actividad antiinflamatoria a través de la modulación de una ruta de señalización inflamatoria u oxidativa que incluye al TNF-α y/o las rutas de señalización dependientes de AMPK (Alappat & Awad, 2010). Como la curcumina regula múltiples blancos moleculares a través de la inducción o inhibición de la expresión génica, las vías de señalización o mediante interacción directa, en este trabajo se estudió el efecto de la curcumina sobre la expresión de PGC-1α, PPARγ y TNF-α en el corazón de ratones diabéticos obesos db/db.
MATERIAL y MÉTODOS
Modelo animal y tratamiento con curcumina
Los ratones fueron mantenidos en el bioterio de la División de Ciencias de la Salud de la Universidad de Guanajuato, siguiendo los lineamientos de ética de la norma (NOM-062-ZOO-1999). Los ratones tuvieron acceso a agua potable estéril y alimento adquirido de Harlan México (23% proteína, 17% grasa y 60% hidratos de carbono) ad libitum.
Se utilizaron tres grupos de ratones (n = 3): silvestres (WT), diabéticos (db/db) y db/db tratados con 0.75% de curcumina (Curcuminoids, Advanced nutrition, Gdl, Jal.) en el alimento (WT, db/db y diabéticos tratados con curcumina [db/db+C], respectivamente) por ocho semanas.
Determinación de peso corporal y glucosa sanguínea
Al inicio y al final del tratamiento los ratones fueron pesados en una balanza granataria (Scout Ohaus, Florham Park N. J.), y al momento del sacrificio se midió la concentración de glucosa en sangre con un kit comercial (Accutrend, GCT, Roche), de acuerdo con las instrucciones del fabricante.
Extracción de proteína total
Los ratones se sacrificaron por decapitación y se obtuvo el corazón, usando un buffer de lavado (20 mM Tris/HCl, 10 mM EDTA, 2 mM DTT, pH 7.8). Las proteínas del corazón se obtuvieron mediante el Sample Grinding Kit (Amersham Biosciences) y centrifugación diferencial, como se reportó previamente (Macías-Cervantes et al., 2014). La proteína se disolvió en 300 μl de buffer de Laemli 2X (Tris-HCl 0.125M, SDS 4%, glicerol 20%, mercaptoetanol 10%, pH 6.8). La concentración de proteína se determinó con un kit comercial (2-D Quant kit, GE Healthcare Biosciences). Se midió la concentración de proteína en un espectrofotómetro Multiskan® a una longitud de onda de 750 nm.
Electroforesis y Western blot
Se cargaron 40 µg de proteína en buffer de Laemli para obtener un volumen final de 15 µL. Se usaron geles de poliacrilamida al 12%, y la electroforesis se realizó en un sistema Mini-PROTEAN Tetra Cell, 200V, 40 min. Para el Western blot se usaron membranas de nitrocelulosa y el sistema Mini Trans-Blot, 90 V, 1.2 h. Las membranas fueron incubadas por 3 h a temperatura ambiente en un buffer de bloqueo (25 mmol/L Tris (pH 7.6), 154 mmol/L NaCl, 0.1% Tween-20 y 2% leche light en polvo). Los anticuerpos primarios (Santa Cruz Biotechnology) se incubaron durante toda la noche a 4 ºC, para PGC-1α (1:1000), PPARγ (1:1000), TNF-α (1:500) y tubulina (1:1000). Los anticuerpos secundarios conjugados a la peroxidasa de rábano picante (HRP, por sus siglas en inglés) (Santa Cruz Biotechnology) se incubaron durante 1.5 h en agitación constante. La quimiodetección se realizó en un fotodocumentador XRS+ System (Bio-Rad, CA). Los resultados se reportan como la relación proteína/α-tubulina.
Análisis estadístico
Se utilizó una prueba de Kruskal Wallis y una prueba a post hocs de Tukey para encontrar diferencias entre los grupos. Los datos se reportan como media ± Error Estándar (EE), para el análisis se usó el software ESTATISTICS10s. Se consideró una diferencia significativa cuando p ≤ 0.05.
RESULTADOS
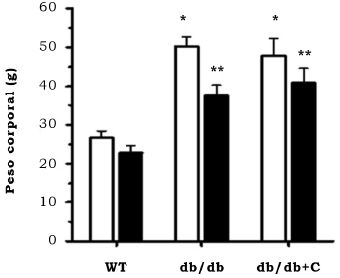
En la figura 1 se observa que el peso inicial y final de los ratones WT fue similar (24.2 g ± 0.8 g y 25.2 ± 0.6 g, respectivamente). El peso inicial de los ratones db/db y db/db+C fue de 46.9 g ± 4.9 g y 47.9 g ± 4.3 g, respectivamente. El peso final de los ratones db/db y db/db+C fue de 34.6 g ± 7.0 g y 40.8 g ± 6.5 g, respectivamente, y fue mayor que el de los ratones WT (22.8 g ± 2.5 g). Los ratones diabéticos pesaron más que los ratones sanos al inicio y al final del tratamiento. En el periodo de tratamiento los ratones db/db perdieron 12.5 g ± 3.0 g, mientras que los ratones del grupo db/db+C perdieron 7.0 g ± 1.3 g. Esta diferencia en la pérdida de peso corporal de los ratones no fue significativa estadísticamente.
| |
 |
|
Figura 1. Efecto de la curcumina sobre el peso corporal de los ratones. WT, ratones control; db/db, ratones diabéticos; db/db+C, ratones diabéticos tratados con curcumina; □, peso inicial; ■, peso final. Los datos representan la media de n = 3 ± EE. * vs WT (inicial), p < 0.001; ** vs WT (final), p < 0.01.
Fuente: Elaboración propia. |
 |
Figura 1. Efecto de la curcumina sobre el peso corporal de los ratones. WT, ratones control; db/db, ratones diabéticos; db/db+C, ratones diabéticos tratados con curcumina; □, peso inicial; ■, peso final. Los datos representan la media de n = 3 ± EE. * vs WT (inicial), p < 0.001; ** vs WT (final), p < 0.01.
Fuente: Elaboración propia. Close |
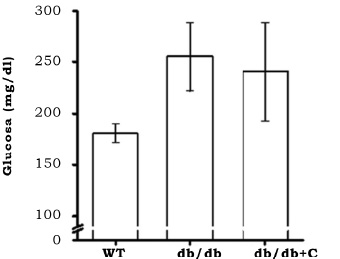
Los ratones diabéticos db/db y db/db+C presentaron mayor concentración de glucosa sanguínea (255.43 mg/dL ± 33.60 mg/dL y 240.66 mg/dL ± 48.11 mg/dL, respectivamente) que los ratones control WT (181 mg/dL ± 9.11 mg/dL, respectivamente), aunque la diferencia estadística no fue significativa (p = 0.07) y la curcumina no tuvo efecto (figura 2).
| |
 |
|
Figura 2. Efecto de la curcumina sobre la concentración de glucosa sanguínea de los ratones. Al final de las ocho semanas de tratamiento se midió la concentración de glucosa sanguínea en los ratones. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. |
 |
Figura 2. Efecto de la curcumina sobre la concentración de glucosa sanguínea de los ratones. Al final de las ocho semanas de tratamiento se midió la concentración de glucosa sanguínea en los ratones. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. Close |
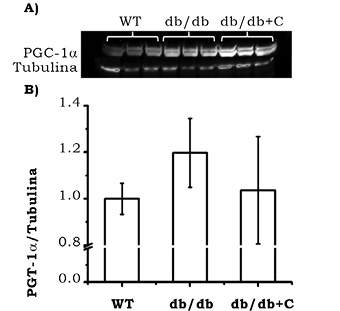
La figura 3 muestra la proporción de la expresión de PGC-1α /tubulina en el corazón de los ratones. No se observaron diferencias significativas entre los grupos WT (1.0 ± 0.067) y los grupos db/db y db/db+C (1.197 ± 0.148 y 1.036 ± 0.230, respectivamente).
| |
 |
|
Figura 3. Efecto de la curcumina sobre la expresión de PGC-1α en corazón de los ratones. A) Western blot representativo de la expresión de PGC-1α. B) Análisis densitométrico de la proporción de PGC-1α/tubulina. Los resultados representan la media de n = 3 ± EE. No hubo diferencia significativa entre grupos.
Fuente: Elaboración propia. |
 |
Figura 3. Efecto de la curcumina sobre la expresión de PGC-1α en corazón de los ratones. A) Western blot representativo de la expresión de PGC-1α. B) Análisis densitométrico de la proporción de PGC-1α/tubulina. Los resultados representan la media de n = 3 ± EE. No hubo diferencia significativa entre grupos.
Fuente: Elaboración propia. Close |
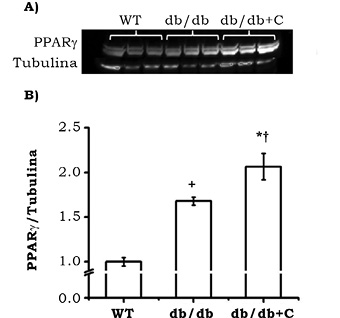
La proporción de expresión de PPARγ/tubulina se encontró incrementada en los grupos de ratones db/db y db/db+C (1.680 ± 0.04 y 2.064 ± 0.14, respectivamente), con respecto al grupo de ratones sanos WT (1.0 ± 0.048). La curcumina incrementó la expresión de PPARγ en el grupo de ratones db/db (figura 4).
| |
 |
|
Figura 4. Efecto de la curcumina sobre la expresión de PPARγ en corazón de los ratones. A) Western blot representativo de la expresión de PPARγ. B)Análisis densitométrico de la proporción de PPARγ/tubulina. Los resultados representan la media de n = 3 ± EE. *vs WT y *vs WT, p < 0.001; †vs db/db, p < 0.01.
Fuente: Elaboración propia. |
 |
Figura 4. Efecto de la curcumina sobre la expresión de PPARγ en corazón de los ratones. A) Western blot representativo de la expresión de PPARγ. B)Análisis densitométrico de la proporción de PPARγ/tubulina. Los resultados representan la media de n = 3 ± EE. *vs WT y *vs WT, p < 0.001; †vs db/db, p < 0.01.
Fuente: Elaboración propia. Close |
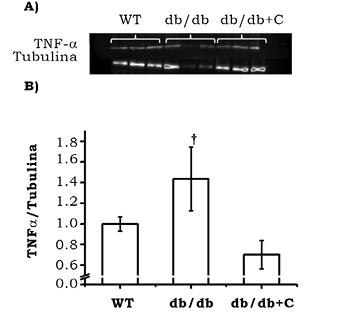
La figura 5 muestra mayor proporción de expresión de TNF-α/tubulina en los ratones db/db (1.185 ± 0.026) que en los ratones sanos WT (1.0 ± 0.019). La curcumina disminuyó la proporción de expresión de TNF-α en el grupo db/db+C (0.700 ± 0.138), con respecto al grupo db/db (p < 0.05).
| |
 |
|
Figura 5. Efecto de la curcumina sobre la expresión de TNF-α en corazón de los ratones. A) Western blot representativo de la expresión de TNF-α. B) Análisis densitométrico de la proporción de TNF-α/tubulina. Los resultados representan la media de n = 3 ± EE. †vs db/db + C, p < 0.01.
Fuente: Elaboración propia. |
 |
Figura 5. Efecto de la curcumina sobre la expresión de TNF-α en corazón de los ratones. A) Western blot representativo de la expresión de TNF-α. B) Análisis densitométrico de la proporción de TNF-α/tubulina. Los resultados representan la media de n = 3 ± EE. †vs db/db + C, p < 0.01.
Fuente: Elaboración propia. Close |
DISCUSIÓN
Durante el tiempo de tratamiento, los ratones diabéticos perdieron peso. Esta pérdida fue menor en los ratones tratados con curcumina, aunque no se alcanzó una diferencia significativa. Otros estudios han reportado en modelos murinos alimentados con dieta alta en grasa, en diabéticos y en humanos, que la suplementación con curcumina disminuye y/o previene la ganancia del peso corporal (Chuengsamarn, Rattanamongkolgul, Luechapudiporn, Phisalaphong & Jirawatnotai, 2012). Sin embargo, se debe considerar la edad del ratón, y con respecto a la curcumina, la dosis, el tiempo de tratamiento y la vía de administración empleada.
En el presente estudio se utilizaron ratones de 15 semanas de edad, edad a la cual la hiperglucemia ha causado alteraciones metabólicas serias que se ven reflejadas en una pérdida acelerada de peso. Probablemente el tratamiento con curcumina ayuda a disminuir estas alteraciones, lo que se ve reflejado en menor pérdida de peso en los ratones diabéticos a las 23 semanas de edad que concluyó el estudio. Esto es apoyado por un estudio realizado en ratones sanos y db/db que fueron alimentados con curcumina (0.02%) durante 6 semanas, el tratamiento con curcumina previno la pérdida de peso (Seo et al., 2008).
En humanos se ha demostrado que la curcumina mejora la retinopatía diabética, aunque la presión sanguínea, frecuencia cardiaca y control diabético se mantuvieron sin cambio (Steigerwalt et al., 2012). Una razón por la cual no se encontraron cambios en la concentración de glucosa de los ratones diabéticos en este estudio puede ser debida al avanzado estado de las complicaciones de la diabetes, tales como marcada hipoinsulinemia y destrucción de las células b pancreáticas reportados en los ratones db/db de 15 a 23 semanas de edad (Dalboge et al., 2013), sugiriendo que la administración de la curcumina fue tardía.
PGC-1α interactúa con diversos factores de transcripción involucrados en el control de rutas biológicas relacionadas con el metabolismo energético en hígado, músculo y tejido adiposo, en la termogénesis adaptativa, biogénesis mitocondrial, metabolismo de glucosa y el desarrollo del tejido cardiovascular, y se encuentra involucrado en el desarrollo de enfermedades como la obesidad, DM2 (Liang & Ward, 2006; Liu & Lin, 2011). En músculo se ha reportado la disminución de la expresión de PGC-1α en pacientes con diabetes y en personas sin diabetes, pero con historial familiar de diabetes (Patti et al., 2003). Interesantemente, los resultados de este trabajo no mostraron diferencia entre grupos, y la curcumina no tuvo el efecto regulador esperado sobre la expresión de PGC-1α. Algunos investigadores sugieren que los efectos de PGC-1α son mediados a través del aumento de su estado actividad y no del aumento de su expresión (Wright et al., 2007).
El PPARγ pertenece a la categoría de las proteínas reguladas por SIRT1, el cual es un regulador del metabolismo de lípidos y glucosa en el tejido adiposo, el músculo, el corazón y el hígado (Picard & Auwerx, 2002). El aumento en la expresión de PPARγ en los ratones diabéticos tratados con curcumina observado en el presente estudio concuerda con lo anterior, considerando que el metabolismo hepático de la glucosa se encuentra alterado en condición de diabetes (Nandi, Kitamura, Kahn & Accili, 2004). Por lo tanto, se considera a PPARγ como un blanco terapéutico para el tratamiento de la DM2. El efecto que la curcumina ejerce sobre PPARγ no se conoce completamente y está poco estudiado, los resultado de este trabajo demuestran que la curcumina incrementó la expresión de PPARγ, como se reportó recientemente en hígado de los ratones db/db (Jiménez-Flores et al., 2014). Esto sugiere que la curcumina tiene un efecto similar a las tiazolinedionas (TZD), un grupo de fármacos que son agonistas de PPARγ y sensibilizantes a la insulina, por lo cual son usados en el tratamiento de la DM2. El PGC-1α regula la expresión de varias proteínas, incluyendo PPARγ. Se ha propuesto que PGC-1α, una vez activado, se une al PPARγ y así regula su actividad, de tal manera que PGC-1α co-activa otros factores de transcripción que controlan la expresión génica (Wright et al., 2007).
Los agonistas de PPARγ reducen la prevalencia de ateroesclerosis, tienen efectos antiproliferativos, disminuyen las citocinas inflamatorias (e.g., TNF-a, IL-6, y IL-1b) y ejercen acciones antioxidantes, inhibiendo tanto la generación de radicales libres como la activación de mediadores inflamatorios en las vasos y en el tejido cardiovascular (Liu et al., 2013). El incremento en la expresión de TNF-α encontrado en los ratones diabéticos concuerda con lo reportado para la inflamación, la obesidad y la resistencia a la insulina (Arkan et al., 2005). La curcumina disminuyó la expresión de TNF-α en los ratones diabéticos, como ha ocurrido en diferentes tejidos (Weisberg, Leibel & Tortoriello, 2008). La disminución en la expresión de TNF-α en los ratones diabéticos es importante, ya que es un factor clave que dispara y aumenta la respuesta inflamatoria crónica. Esto lo hace un blanco terapéutico importante para el tratamiento de la obesidad y la diabetes, y la curcumina disminuyó su expresión a niveles menores a los del grupo control.
El aumento de la expresión de PPARγ observado probablemente regula la expresión de diversos genes relacionados con el metabolismo de la glucosa y los ácidos grasos, entre otros. Además, los resultados de este trabajo también sugieren que la curcumina tiene efecto benéfico a través de la disminución de la expresión de TNF-α en los ratones diabéticos, lo cual se traduce en la disminución de la inflamación presente en la obesidad y DM2.
AGRADECIMIENTOS
Esta investigación fue financiada por la Dirección de Apoyo a la Investigación y al Posgrado (DAIP), de la Universidad de Guanajuato. Lizbeth M. Jiménez-Flores obtuvo una beca del Consejo Nacional de Ciencia y Tecnología (Conacyt) para la realización de estudios de maestría (269733), por tal motivo extiende un agradecimiento.
REFERENCES
Al-Mukhtar, S. B., Fadhil, N. N. & Hanna, B. E. (2012). General and gender characteristics of type 2 diabetes mellitus among the younger and older age groups. Oman Medical Journal, 27(5), 375-382.
Alappat, L. & Awad, A. B. (2010). Curcumin and obesity: evidence and mechanisms. Nutrition Reviews, 68(12), 729-738.
Arkan, M. C., Hevener, A. L., Greten, F. R., Maeda, S., Li, Z. W., Long, J. M., Wynshaw-Boris, A., Poli, G., Olefsky, J. & Karin, M. (2005). IKK-beta links inflammation to obesity-induced insulin resistance. Nature Medicine, 11(2), 191-198.
Barrera-Cruz, A., Rodríguez-González, A. & Molina-Ayala, M. A. (2013). The current state of obesity in Mexico. Revista Médica del Instituto Mexicano del Seguro Social, 51(3), 292-299.
Chuengsamarn, S., Rattanamongkolgul, S., Luechapudiporn, R., Phisalaphong, C. & Jirawatnotai, S. (2012). Curcumin extract for prevention of type 2 diabetes. Diabetes Care, 35(11), 2121-2127.
Dalboge, L. S., Almholt, D. L., Neerup, T. S., Vassiliadis, E., Vrang, N., Pedersen, L., Fosgerau, K. & Jelsing, J. (2013). Characterisation of age-dependent beta cell dynamics in the male db/db mice. PLoS One, 8(12), e82813.
Folli, F., Okada, T., Perego, C., Gunton, J., Liew, C. W., Akiyama, M., D’Amico, A., La Rosa, S., Placidi, C., Lupi, R., Marchetti, P., Sesti, G., Hellerstein, M., Perego, L. & Kulkarni, R. N. (2011). Altered insulin receptor signalling and beta-cell cycle dynamics in type 2 diabetes mellitus. PLoS One, 6(11), e28050.
Franco-Robles, E., Campos-Cervantes, A., Murillo-Ortiz, B. O., Segovia, J., López-Briones, S., Vergara, P., Pérez-Vázquez, V., Solis-Ortiz, M. S. & Ramírez-Emiliano, J. (2014). Effects of curcumin on brain-derived neurotrophic factor levels and oxidative damage in obesity and diabetes. Applied Physiology, Nutrition and Metabolism, 39(2), 211-218.
Gupta, S. C., Patchva, S., Koh, W. & Aggarwal, B. B. (2012). Discovery of curcumin, a component of golden spice, and its miraculous biological activities. Clinical and Experimental Pharmacology and Physiology, 39(3), 283-299.
Jiménez-Flores, L. M., López-Briones, S., Macías-Cervantes, M. H., Ramírez-Emiliano, J. & Pérez-Vázquez, V. (2014). A PPARgamma, NF-kappaB and AMPK-dependent mechanism may be involved in the beneficial effects of curcumin in the diabetic db/db mice liver. Molecules, 19(6), 8289-8302.
Liang, H. & Ward, W. F. (2006). PGC-1alpha: a key regulator of energy metabolism. Advances in Physiology Education, 30(4), 145-151.
Liu, C. & Lin, J. D. (2011). PGC-1 coactivators in the control of energy metabolism. Acta Biochim Biophys Sin (Shanghai), 43(4), 248-257.
Liu, Z. J., Liu, W., Liu, L., Xiao, C., Wang, Y. & Jiao, J. S. (2013). Curcumin Protects Neuron against Cerebral Ischemia-Induced Inflammation through Improving PPAR-Gamma Function. Evidence-Based Complementary and Alternative Medicine, vol. 2013. doi:10.1155/2013/470975
Macías-Cervantes, M. H. , Guzmán-Flores, J. M, Vargas-Ortiz, K, Díaz-Cisneros, F. J., Ramírez-Emiliano, J. & Pérez-Vázquez, V. (2014). Effect of Aerobic Exercise on Protein Expression in Muscle of Obese Mexican Adolescents: A Proteomic and Bioinformatic Analysis. Natural Science, 6(9), 641-650.
Moller, D. E. (2001). New drug targets for type 2 diabetes and the metabolic syndrome. Nature, 414(6865), 821-827.
Nandi, A., Kitamura, Y., Kahn, C. R. & Accili, D. (2004). Mouse models of insulin resistance. Physiological Reviews, 84(2), 623-647.
Norma Oficial Mexicana (1999). (NOM-062-ZOO-1999). Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio.
Oakhill, J. S., Scott, J. W. & Kemp, B. E. (2012). AMPK functions as an adenylate charge-regulated protein kinase. Trends in Endocrinology & Metabolism, 23(3), 125-132.
Patti, M. E., Butte, A. J., Crunkhorn, S., Cusi, K., Berria, R., Kashyap, S., Miyazaki, Y., Kohane, I., Costello, M., Saccone, R., Landaker, E. J., Goldfine, A. B., Mun, E., DeFronzo, R., Finlayson, J., Kahn, C. R. & Mandarino, L. J. (2003). Coordinated reduction of genes of oxidative metabolism in humans with insulin resistance and diabetes: Potential role of PGC1 and NRF1. Proccedings of the National Academy of Sciences USA, 100(14), 8466-8471.
Picard, F. & Auwerx, J. (2002). PPAR(gamma) and glucose homeostasis. Annual Reviews of Nutrition, 22, 167-197. doi: 10.1146/annurev.nutr.22.010402.102808
Schuster, D. P. (2010). Obesity and the development of type 2 diabetes: the effects of fatty tissue inflammation. Journal of Diabetes, Metabolic Syndrome and Obesity, 3, 253-262.
Seo, K. I., Choi, M. S., Jung, U. J., Kim, H. J., Yeo, J., Jeon, S. M. & Lee, M. K. (2008). Effect of curcumin supplementation on blood glucose, plasma insulin, and glucose homeostasis related enzyme activities in diabetic db/db mice. Molecular Nutrition & Food Research, 52(9), 995-1004.
Steigerwalt, R., Nebbioso, M., Appendino, G., Belcaro, G., Ciammaichella, G., Cornelli, U., Luzzi, R., Togni, S., Dugall, M., Cesarone, M. R., Ippolito, E., Errichi, B. M., Ledda, A., Hosoi, M. & Corsi, M. (2012). Meriva(R), a lecithinized curcumin delivery system, in diabetic microangiopathy and retinopathy (Controlled Clinical Trial). Panminerva Medica, 54(1 Suppl 4), 11-16.
Weisberg, S. P., Leibel, R. & Tortoriello, D. V. (2008). Dietary curcumin significantly improves obesity-associated inflammation and diabetes in mouse models of diabesity. Endocrinology, 149(7), 3549-3558.
Wright, D. C., Han, D. H., Garcia-Roves, P. M., Geiger, P. C., Jones, T. E. & Holloszy, J. O. (2007). Exercise-induced mitochondrial biogenesis begins before the increase in muscle PGC-1alpha expression. Journal of Biological Chemistry, 282(1), 194-199.
Xu, H., Barnes, G. T., Yang, Q., Tan, G., Yang, D., Chou, C. J., Sole, J., Nichols, A., Ross, J. S., Tartaglia, L.A. & Chen, H. (2003). Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. Journal of Clinical Investigation, 112(12), 1821-1830.
Zhang, D. W., Fu, M., Gao, S. H. & Liu, J. L. (2013). Curcumin and diabetes: a systematic review. Evidence-Based Complementary and Alternative Medicine, vol. 2013. doi:10.1155/2013/636053