The cheese industries generate two types of whey, sweet (SW) and acid (AW). Few studies have used both types of whey to produce 2-fenilethanol (2-FE), as well as nuclear magnetic resonance (NMR) to determine the percentage of α-β in each type of whey. We assessed the production of 2-phenyl ethanol (2-FE) by Kluyveromyces marxianus using as SW and AW as substrates. Both types of whey were treated at pH 4.8 and pasteurized at 63 °C for 30 min with an initial inoculum of K. marxianus (1 × 106 CFU/mL). The identification and quantification of 2-PHE was performed by gas chromatography (GC). We then determined the (α-β) lactose by nuclear magnetic resonance (NMR). K. marxianus was capable of producing 2-FE in the two types of whey in obtaining maximum concentrations of 0.44 g/L and 0.32 g/L, respectively. For SW, we found a concentration of β-lactose 82.35%.
INTRODUCCIÓN
La industria láctea genera diversos residuos resultado del proceso de manufactura de la leche, entre estos residuos se encuentra el lactosuero (Carlvahlo, Prazeres & Rivas, 2013). El lactosuero es el líquido que queda después de la separación de la cuajada durante el proceso de fabricación del queso y contiene alrededor del 50% de los nutrientes de la leche (Parra, 2009; Prudêncio, Müller, Fritzen-Freire, Castanho & Cunha, 2014). La mayor producción de lactosuero proviene de la Unión Europea y de los Estados Unidos de América (aproximadamente el 70% del total del lactosuero producido a nivel mundial) (Mollea, Marmo & Bosco, 2013). Por otra parte, la tasa de producción de lactosuero tiene un crecimiento global del 2% anual, similar que la cantidad producida de leche (Smithers, 2008; Yavad et al., 2014).
Existen varios tipos de lactosuero dependiendo principalmente de la eliminación de la caseína, entre los principales se encuentran el lactosuero dulce y ácido, el primero se obtiene por la acción de la renina en la coagulación de la caseína a pH 6.5 (Arrojo, Omil, Garrido & Méndez, 2003). El lactosuero ácido se produce cuando la coagulación es por acidificación a un pH alrededor de 5.6 (Parra, 2009).
Independientemente del lactosuero que se genere, parte de la producción es destinada al consumo animal (20%), aplicaciones alimentarias (20%) y el resto es vertido sin tratamiento al ambiente (60%) (Valencia & Ramírez, 2009; Yavad et al., 2014). Su vertido crea problemas ambientales y de salud significativos debidos a los altos volúmenes generados; así como a la elevada carga orgánica. La elevada carga orgánica es atribuida al contenido de lactosa (40 g/L – 60 g/L) y grasa (0.08 g/L – 10.6 g/L), convirtiéndolo en un residual altamente contaminante cuando es vertido sin tratamiento al ambiente (Carvalho et al., 2013; Prazeres, Carvalho & Rivas, 2012). Este presenta valores de la Demanda Bioquímica de Oxígeno (30 g/L – 50 g/L) y Demanda Química de Oxígeno (60 g/L – 80 g/L) que se encuentran por encima de las normas establecidas (Spălățelu, 2012).
Su continua descarga representa un considerable riesgo de eutrofización en cuerpos de agua (Prazeres et al., 2012). Adicionalmente a ello, ocasiona un rápido consumo de oxígeno, grasas de flotación, formación de espuma, salinización, acidificación, generación de olores desagradables, entre otros (Prazeres, Carvalho & Rivas, 2013).
Sin embargo, la bioconversión del lactosuero, importante por su contenido en lactosa y considerado como un sustrato económico, es de gran interés para producir compuestos de valor agregado (Aggelopoulos et al., 2014; Hadiyanto, Ariyanti, Aini & Pinundi, 2014; Páez, Pérez, Araujo, Mármol & Rincón, 2012). Dentro de estos compuestos se podría producir el 2-feniletanol (2-FE) (C8H10O), el cual es un alcohol con aroma a rosas (Mihal, Krištofíková & Marcŏs, 2013). El 2-FE es ampliamente utilizado en la industria alimentaria para la modificación de las composiciones organolépticas del sabor (olor, sabor, textura, color) de fórmulas frutales, helados, dulces, bebidas sin alcohol, gelatinas, pudines, goma de mascar, entre otros (Garavaglia, Hickmann, Mara, Carmo & Záchia, 2007). En la industria farmacéutica tiene aplicación como anestésico local y antiséptico (Lomascolo et al., 2001). El 2-FE es utilizado también en la elaboración de perfumes y cosméticos (Etschmann, Bluemke, Sell & Schrader, 2002).
La demanda de 2-FE obtenido por procesos bioquímicos es cada vez mayor (Achmon, Zelas & Fishman, 2013; Wittmann, Hans & Bluemke, 2002). El 2-FE puede ser sintetizado por ciertas levaduras a través de dos rutas independientes teniendo como precursor la L-fenilalanina (Celiska, Kubiak, Bialas, Dziadas & Grajek, 2013). Se ha reportado que Kluyveromyces marxianus tiene la capacidad de producir altas concentraciones de 2-FE y de utilizar la lactosa como fuente de carbono (Gupte & Nair, 2010; Zhou, Xu, Chi, Liu & Chi, 2013).
La producción de 2-FE utilizando K. marxianus, se ha realizado empleando diversos sustratos, en su mayoría sintéticos (base nitrogenada con extracto de levadura, base glucosa-peptona-extracto de levadura, etc.) (Dragone, Mussatto, Oliviera & Teixeira, 2009; Etschmann et al., 2002; Etschmann & Schrader, 2006; Etschmann, Sell & Schrader, 2004; Fabre, Blanc & Goma, 1998). El objetivo fue evaluar los dos tipos de lactosuero (LD y LA) obtenidos de la industria quesera para la producción de 2-FE, como la búsqueda de una alternativa económica y viable para reducir el impacto ambiental de éste residual.
MÉTODOS
Preparación de los dos tipos de lactosuero
Se utilizó lactosuero dulce (LD) y ácido (LA) proporcionado por la industria quesera PROUNILAC del estado de Hidalgo (Hidalgo, México). El suero se tomó directamente de la línea de producción del queso, este se colocó en contenedores de polietileno de 4 L, hasta el laboratorio y se almacenó a 4 °C, hasta su uso. Se ajustó el pH de los dos tipos del lactosuero (LD y LA) a 4.8 con H2SO4 1N y se pasteurizó a 63 °C/30 min. Se prepararon lotes con 100 mL de cada tipo de lactosuero.
Material biológico
El microorganismo utilizado fue la cepa de K. marxianus ITD00262, que fue aislada e identificada por Páez, Arias, Rutiaga, Barrio & Soto (2013). Esta fue conservada en placas con medio AME [Agar para métodos estándar (Bioxon, México) a 4 °C, hasta su uso.
Producción de 2-FE
La cepa de K. marxianus se sembró en placa de petri con medio AME y se incubó a 30 °C/24 h (Arsa, México). Una asada del cultivo fue transferida a un matraz Erlenmeyer conteniendo 100 mL de caldo LPY [Lactosa-Peptona-Extracto de Levadura (Bioxon, México)] a pH de 4.8. El matraz se incubó en agitación (180 rpm, Shaker Thermo Scientific) durante 12 h a 30 °C. Posteriormente, se realizaron diluciones decimales con diluyente de peptona (Bioxón, México) para tener un inoculo inicial de 1 × 106 UFC/mL; este inoculo fue adicionado al lote de matraces para cada tipo de lactosuero (LD y LA) previamente preparado (pH de 4.8), los matraces se incubaron en agitación (180 rpm) a 30 °C por 72 h. Cada 24 h se tomaron alícuotas de 1 ml de cada matraz, se colocaron en tubos estériles de plástico (Eppendorf, México) y se almacenaron a 4 °C hasta su análisis por cromatografía de gases para detectar la producción de 2-FE. El procedimiento antes mencionado, se realizó por triplicado.
Conteo de levaduras
Periódicamente, a partir de cada matraz, se efectuó el recuento de las levaduras mediante la técnica de conteo directo al microscopio utilizando la cámara de Neubauer (Marienfeld, Germany), usando volúmenes de 20 μL para el conteo en cada muestra. Las células teñidas con azul de metileno fueron consideradas como viables.
Cuantificación de 2-FE
Para la detección y cuantificación de 2-FE en las muestras de los dos tipos de lactosuero fermentado, los tubos estériles de plástico (Eppendorf, México) que contenían 1 mL de las muestras de lactosuero fueron centrifugados a 6000 rpm/3 min. Se retiró el sobre nadante y este se filtró con membranas de celulosa con un diámetro de poro de 0.5 µm; el filtrado se analizó directamente por cromatografía de gases. Se utilizó un cromatógrafo de gases Perkin Elmer N931-6403 (Norwalk,USA), equipado con un detector FID, provisto de una columna DB WAX J&W Scientifics (Virgin Islands, USA) (60 m × 0.25 mm × 0.25 µm). Las temperaturas del inyector y del detector fueron de 250 °C y 300 °C, respectivamente. Se utilizó nitrógeno como gas portador a un flujo de 1 mL/min para todas las muestras. El extracto inyectado fue de 2 µL; los compuestos (2-feniletanol y etanol) se identificaron y se cuantificaron por comparación con patrones. La inyección de las muestras se realizó por duplicado.
Resonancia magnética nuclear (RMN de lactosa para lactosuero dulce (LD) y lactosuero ácido (LA)
Las muestras de los dos tipos de lactosuero contenidas en tubos estériles de plástico (Eppendorf, México) fueron centrifugadas a 6000 rpm/6 min. Posteriormente, fueron calentadas a 60 °C/30 min hasta evaporar el exceso de humedad. Las muestras se solubilizaron en 1 mL de D2O (agua deuterada). Los espectros de RMN se obtuvieron utilizando un espectrómetro de resonancia magnética nuclear (Varian NMR, 400 MHz). Con la finalidad de determinar la conformación de lactosa para cada tipo de lactosuero y su efecto sobre la producción de 2-FE producido por Kluyveromyces marxianus. Los espectros de RMN se procesaron y analizaron utilizando el programa Chemistry.
Modelos matemáticos
Se utilizaron las ecuaciones del modelo de Monod para calcular la tasa de formación de producto (rp), el rendimiento de biomasa (Yx(biomasa)/s(lactosa)) y la tasa de consumo de sustrato (-rs); así como la ecuación para determinar la inhibición por producto (rg). Los datos experimentales obtenidos por cromatografía de gases se ajustaron de manera independiente en las ecuaciones matemáticas de Gompertz, Logístico y Richards, por regresión no lineal de acuerdo a Zwietering, Jongenburger, Rombouts & Van`t, (1990), con el algoritmo de Marquardt. La obtención de los valores de las constantes a, xc y k, se realizó con ayuda del programa OriginPro versión 8.1, usando el método de mínimos cuadrados con un intervalo de confianza de 95%; a, xc y k son parámetros que describen el comportamiento sigmoidal y sirven para determinar la fase de latencia (λ) y la velocidad máxima específica de crecimiento (μm). Una vez calculados los valores de a, xc y k, como solución al modelo aplicado, se obtuvieron los valores de μm y λ, mediante la ecuación correspondiente con su solución (Zwietering et al., 1990). El tiempo de generación (tg), se calculó de acuerdo a Dalgaard, Kamperman, Neumeyer & McMeekin (1994).
Análisis estadístico
Los datos fueron analizados con un análisis de varianza de una sola vía (ANOVA), por comparación de medias por LSD (desviación de mínimos cuadrados) con un nivel de confianza del 95%, utilizando el software STATISTICA versión 8.0.
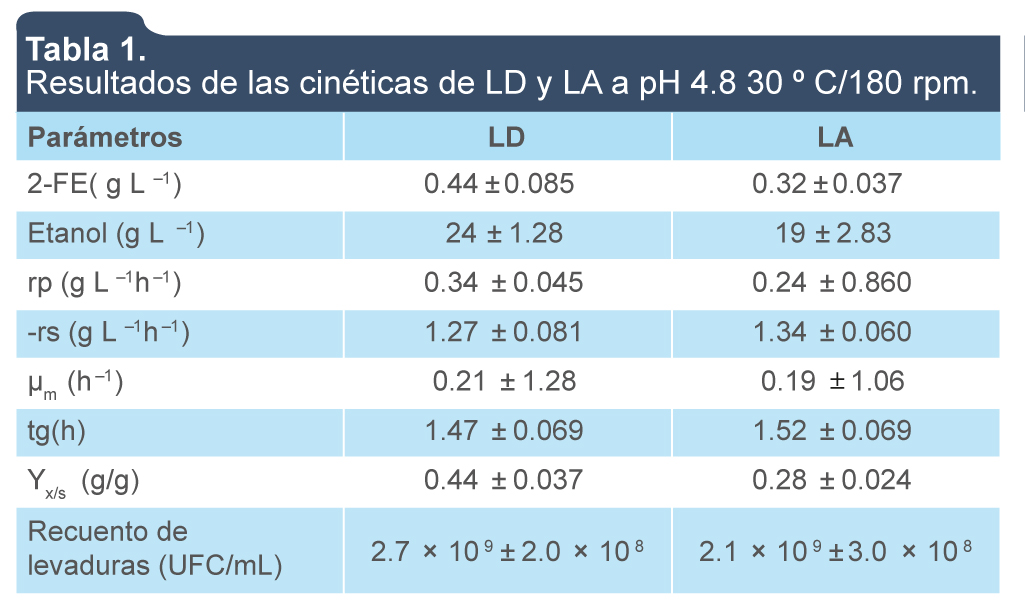
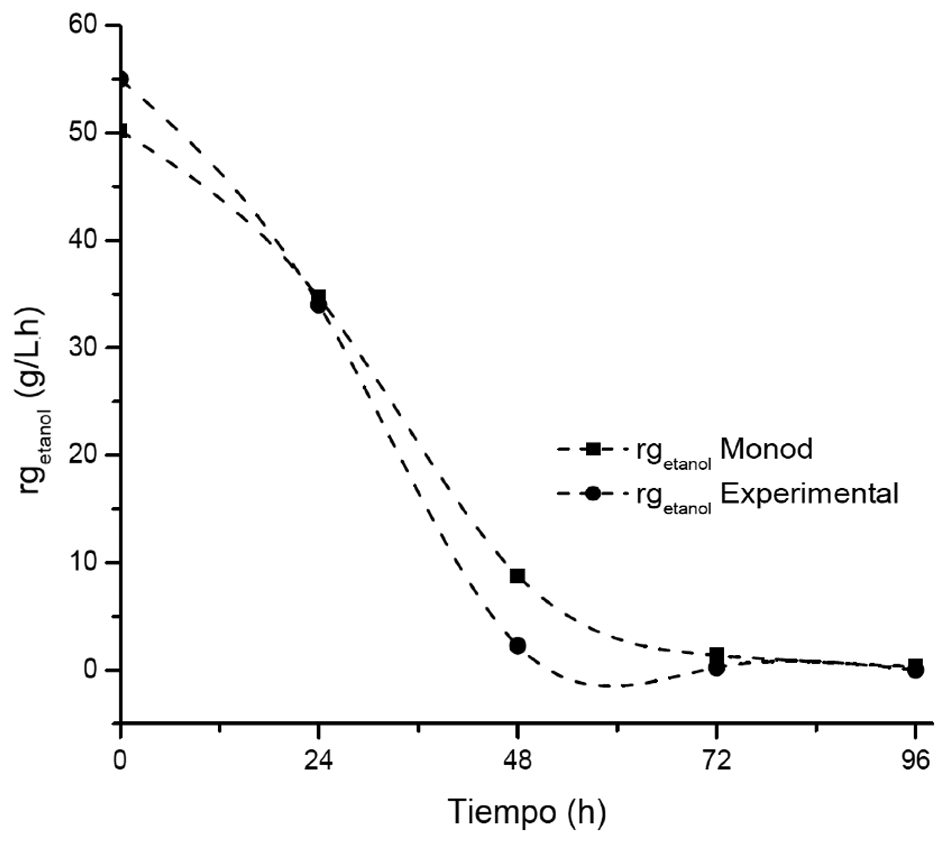
Se observó que K. marxianus fue capaz de producir 2-FE en los dos tipos de lactosuero (tabla 1). Las máximas concentraciones de 2-FE obtenidas fueron de 0.44 (LD) y 0.32 (LA) g/L a las 24 h para cada tipo de lactosuero, respectivamente. La velocidad de formación de producto (rp) fue ligeramente mayor para el LD (0.34 g L–1h–1) en comparación LA (tabla 1). Estos resultados ajustados con el modelo de Monod (R2 0.98) indican que la formación de 2-FE se encuentra asociada con el crecimiento exponencial a lo largo de las fermentaciones. Este comportamiento ya ha sido descrito por algunos autores (Etschmann et al., 2004; Garavaglia et al., 2007; Stark, Münch, Sonnleitner, Marison & Stockar, 2003). Sin embargo, la concentración formada de etanol en LD (24 g L–1) y LA (19 g L–1), indican que este no fue utilizado como fuente de carbono por la vía que envuelve el glioxilato en el caso del LA, favoreciendo la producción de 2-FE como se ha reportado previamente (Wittmann et al., 2002). Para LA, los resultados de la ecuación de Monod muestran una inhibición por producto (rg) para etanol de 1.37 g L–1 h–1 con un Kobs = 0.28; n = 0.5 y un coeficiente de correlación (R2) de 0.99 (figura 1).
Tabla 1.
Resultados de las cinéticas de LD y LA a pH 4.8 30 º C/180 rpm.
|
|
Parámetros
|
LD
|
LA
|
|
2-FE( g L–1)
|
0.44 ± 0.085
|
0.32 ± 0.037
|
|
Etanol (g L–1)
|
24 ± 1.28
|
19 ± 2.83
|
|
rp (g L-1h-1)
|
0.34 ± 0.045
|
0.24 ± 0.860
|
|
-rs (g L-1h-1)
|
1.27 ± 0.081
|
1.34 ± 0.060
|
|
μm (h–1)
|
0.21 ± 1.28
|
0.19 ± 1.06
|
|
tg(h)
|
1.47 ± 0.069
|
1.52 ± 0.069
|
|
Yx/s (g/g)
|
0.44 ± 0.037
|
0.28 ± 0.024
|
|
Recuento de
levaduras (UFC/mL)
|
2.7 × 109 ± 2.0 × 108
|
2.1 × 109 ± 3.0 × 108
|
tg: tiempo de generación; Yx/s: rendimiento de biomasa; rp: velocidad de formación de producto; -rs: velocidad de consumo de sustrato.
Fuente: Elaboración propia.
Abrir
 |
tg: tiempo de generación; Yx/s: rendimiento de biomasa; rp: velocidad de formación de producto; -rs: velocidad de consumo de sustrato.
Fuente: Elaboración propia. Close |
|
|
|
 |
|
|
Figura 1. Ajuste del modelo de Monod para la velocidad de formación del producto de las fermentaciones de LA a pH 4.8, 30 °C/180 rpm.
Fuente: Elaboración propia. |
 |
Figure 1. Ajuste del modelo de Monod para la velocidad de formación del producto de las fermentaciones de LA a pH 4.8, 30 °C/180 rpm.
Fuente: Elaboración propia. Close |
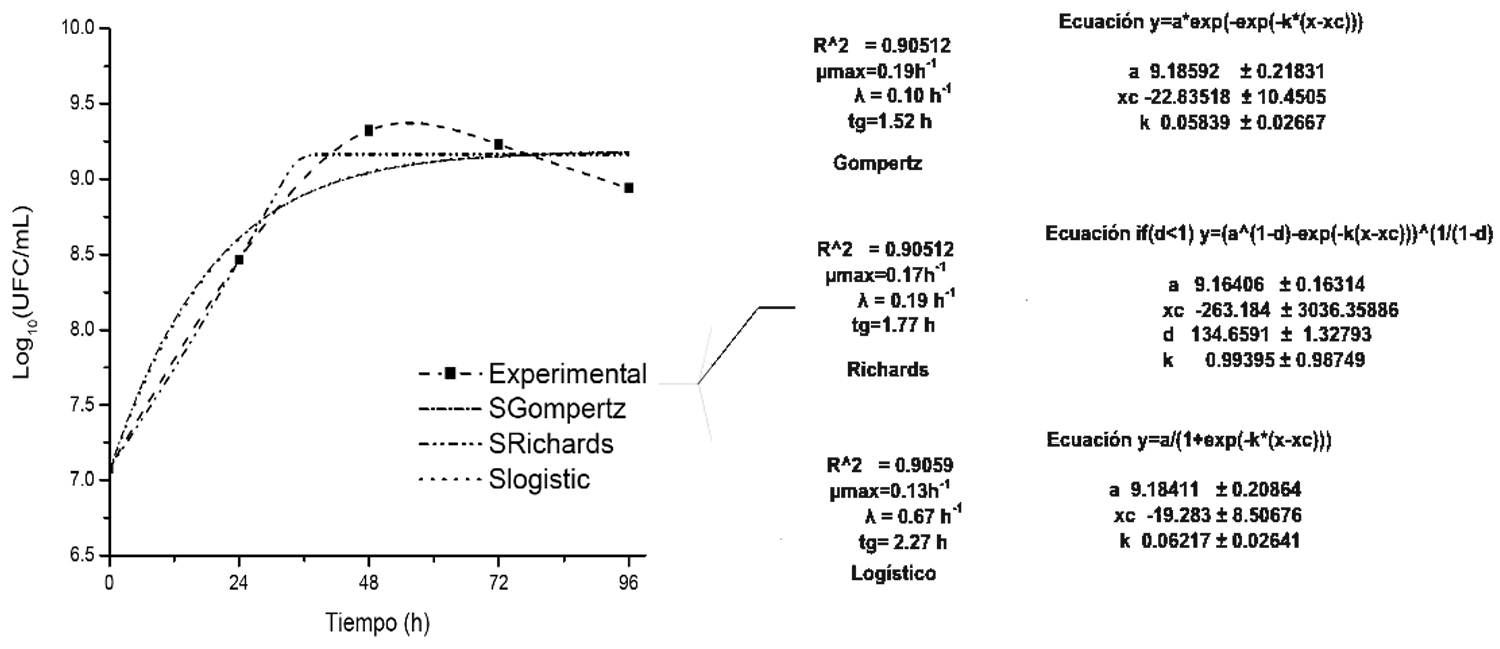
Respecto al crecimiento, se observó un incremento máximo en la concentración de K. marxianus de 2.7 × 109 y 2.1 × 109 UFC/mL para LD y LA, respectivamente. Estos resultados, del recuento celular son superiores a lo reportado por Yadav et al. (2014) quienes reportaron un máximo alcanzado de 5.10 × 108 UFC/mL en lactosuero diluido. La velocidad máxima específica (μm) de crecimiento de K. marxianus utilizando el ajuste de los modelos Gompertz, Richards y Logístico fueron similares con valores que fluctuaron de 0.15 h–1 a 0.21 h–1 con un coeficiente de correlación (R2) de 0.98 (figura 2). Las velocidades específicas de crecimiento (µm) para ambos lactosueros son menores que las reportadas por Araujo et al. (2007), quienes obtuvieron una μm de 0.29 h–1.
|
|
|
 |
|
|
Figura 2. Ajuste del modelo Gompertz, Richards y Logístico para las fermentaciones de lactosuero ácido a pH 4.8, 30 °C/180 rpm, donde a, xc y k son parámetros matemáticos que describen la curva sigmoidal.
Fuente: Elaboración propia. |
 |
Figura 2. Ajuste del modelo Gompertz, Richards y Logístico para las fermentaciones de lactosuero ácido a pH 4.8, 30 °C/180 rpm, donde a, xc y k son parámetros matemáticos que describen la curva sigmoidal.
Fuente: Elaboración propia. Close |
Por otro lado, los tiempos de generación obtenidos en cada tipo de lactosuero concuerdan con lo reportado para K. marxianus en medios nutritivos (Banat, Nigam, Singh, Marchant & McHale, 1998; Singh, Nigam, Banat, Marchant & McHale, 1998) (tabla 1). Sin embargo, el crecimiento obtenido, determinado por el tiempo de generación (tg) para LD (1.47) y LA (1.52 h), es más rápido que el reportado por Mendoza, Rivas, Emperatriz, Delahaye y Bertsch (2006), quienes obtuvieron un tg de 1.65 h en lactosueros desproteinizado. Lo que refleja la afinidad de la cepa utilizada bajo los sustratos empleados.
En nuestro caso, se obtuvo un rendimiento de biomasa (Yx/s, en base a lactosa) de 0.28 g/g para LA, seguido del LD (0.44 g/g) (tabla 1). Los resultados para LD son superiores a lo reportado por Paez et al. (2012), quienes obtuvieron un rendimiento de 0.20 g/g en lactosuero.
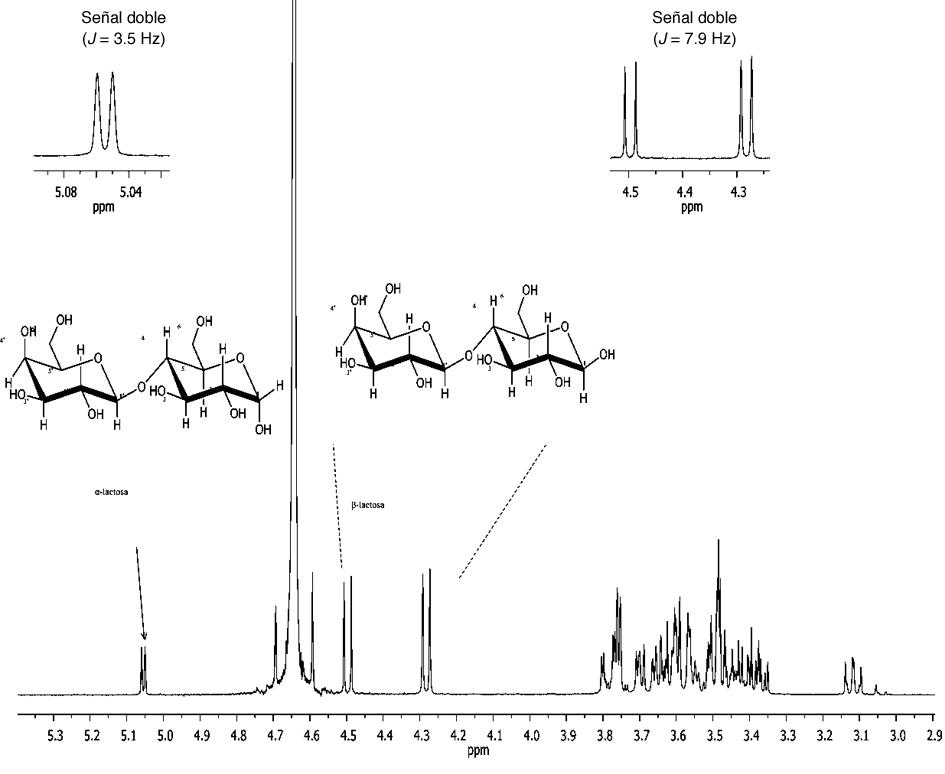
Respecto a la tasa de consumo de sustrato (-rs) para LD y LA fermentados las concentraciones fueron similares con 1.27 g L–1 h–1 y 1.34 g L–1 h–1 (tabla 1), respectivamente. Estos resultados se ven reflejados en la producción de 2-FE. Adicionalmente a ello, la conformación de lactosa presente en cada lactosuero observada en los espectros de RMN de 1H correspondientes al LD (figura 3) presentó entre sus señales más significativas, dos señales dobles (J = 7.9 Hz) en δ 4.49 y 4.28 ppm, características de protones anoméricos, asignados para H–1 y H–1', correspondientes a la β-lactosa. Entre δ3.8 y 3.0 ppm, se observó el resto de las señales presentes en la estructura. Adicionalmente, en δ 5.06 ppm, se observó una señal doble (J = 3.5 Hz), que podría corresponder al protón anomérico de la β-lactosa.
|
|
|
 |
|
|
Figura 3. Espectro de RMN de 1H a 400 MHz en D2O de la lactosa del lactosuero dulce.
Fuente: Elaboración propia. |
 |
Figura 3. Espectro de RMN de 1H a 400 MHz en D2O de la lactosa del lactosuero dulce.
Fuente: Elaboración propia. Close |
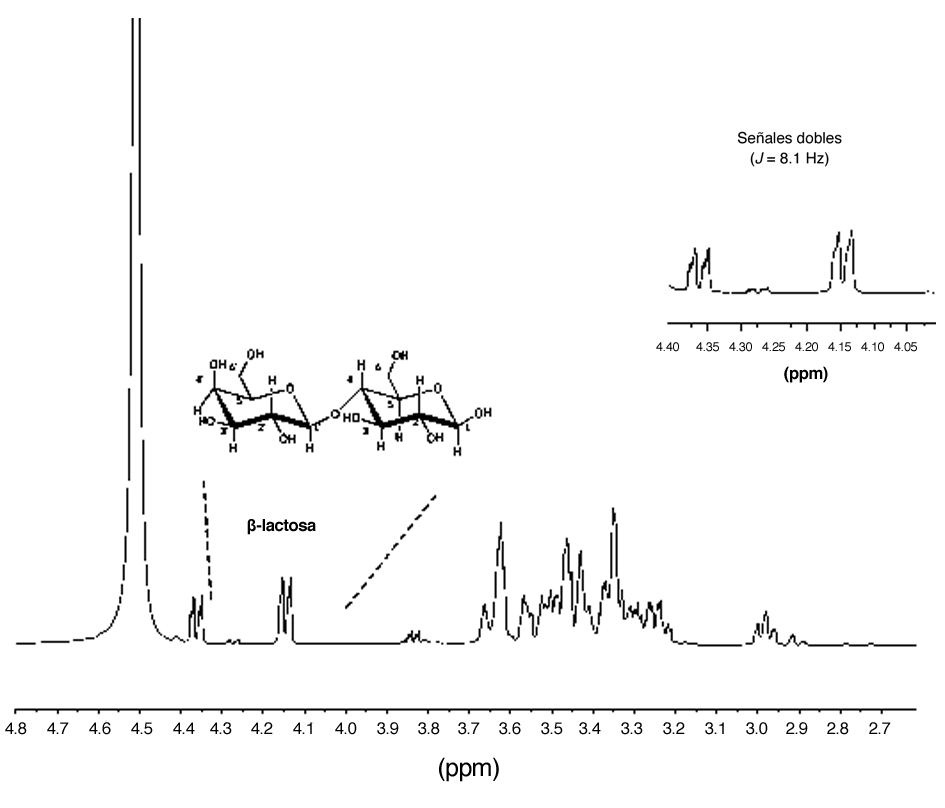
Sin embargo, para el LA, el espectro de RMN de 1H (figura 4) presentó entre sus señales más significativas, dos señales dobles (J = 8.1 Hz) en δ 4.36 y 4.15 ppm, características de protones anoméricos, asignados para H-1 y H-1', correspondientes a la β-lactosa. Entre δ3.7 y 2.9 ppm, se observaron el resto de las señales presentes en la estructura.
|
|
|
 |
|
|
Figura 4. Espectro de RMN de 1H a 400 MHz en D2O de la lactosa del lactosuero ácido.
Fuente: Elaboración propia. |
 |
Figura 4. Espectro de RMN de 1H a 400 MHz en D2O de la lactosa del lactosuero ácido.
Fuente: Elaboración propia. Close |
Con los resultados previamente descritos, determinamos para el LD el contenido de β-lactosa que fue del 82.35%, mientras que para el LA el contenido de β-lactosa fue de 72.51%. Estas diferencias podrían haber influido sobre la producción de 2-FE por K. marxianus en LD, el contenido de β-lactosa, tiene un mayor contenido de azúcar y la solubilidad es mayor. Además de lo antes mencionado, otros nutrientes como el nitrógeno fácilmente asimilable (NFA) pudieron haber influido en la formación de 2-FE; ya que se ha reportado que es necesaria una fuente de nitrógeno adecuada para la producción del 2-FE (Äyräpää, 1965; Etschmann et al., 2002). Por otro lado, el LA presentó una inhibición por producto para etanol.
CONCLUSIONES
K. marxianus fue capaz de producir 2-FE a partir de los desechos de la industria quesera, presentados como LD y LA. Sin embargo, el LD es un sustrato potencial para la producción de 2-FE, que se debe a la conformación de lactosa en este tipo de lactosuero. Sin embargo, el LA no puede descartarse debido a su potencial en la producción de biomasa y etanol. Por otro lado, este estudio podría representar un uso alternativo para este tipo de desecho y disminuir con ello su impacto ambiental cuando es vertido sin tratamiento.
AGRADECIMIENTOS
Se agradece a la productora de lácteos PROUNILAC por el apoyo al acceso de las muestras.
REFERENCIAS
Achmon, Y., Zelas, Z., & Fishman, A. (2013). Cloning Rosa hybrid phenylacetaldehy de synthase for the production of 2-phenylethanol in a whole cell Escherichia coli system. Applied Microbiology and Biotechnology, 98(8), 3603-3611.
Aggelopoulos, T., Katsieris, K., Bekatorou, A., Pandey, A., Banat, M. I., & Koutinas, A. A. (2014). Solid state fermentation of food waste mixtures for single cell protein, aroma volatiles and fat production. Food Chemistry, 145(3), 710-716.
Araujo, K., Páez, G., Mármol, Z., Ferrer, J., Ramones, E., Mazzarri, C. I., & Rincón, M. (2007). Effect of lactose concentration on the grow kinetics of Kluyveromyces marxianus var. marxianus and production of β-D-galactosidade. Revista Técnica de la Facultad de Ingeniería Universidad del Zulia, 1(1), 64-73.
Arrojo, B., Omil, F., Garrido, J. M., & Méndez, R. (2003). Combinación de un filtro anaerobio y un sistema SBR para el tratamiento de las aguas generadas en un laboratorio de análisis de productos lácteos. Revista Afinidad, 60(5), 344-354.
Äyräpää, T. (1965). The formation of phenethyl alcohol from 14C labelled phenylalanine. Journal Institute of Brewing, 71(3), 341-347.
Banat, I. M., Nigam, P., Singh, D., Marchant, R., & McHale, A. P. (1998). Ethanol production at elevated temperatures and alcohol concentrations: Part I - Yeasts in general. World Journal of Microbiology and Biotechnology, 14 (6), 809-821.
Carlvalho, F., Prazeres, R. A., & Rivas, J. (2013). Cheese whey wastewater: Characterization and treatment. Science of The Total Environment, 445(1), 385-396.
Celińska, E., Kubiak, P., Bialas, W., Dziadas, M., & Grajek, W. (2013). Yarrowia lipolytica: the novel and promising 2-phenylethanol producer. Journal of Industrial Microbiology and Biotechnology, 40(6), 389-392.
Dalgaard, P., Ross, T., Kamperman, L., Neumeyer, K., & McMeekin, T.A. (1994). Estimation of bacterial growth rates from turbidimetric and viable count data. International Journal of Food Microbiology, 23(9), 391-404.
Dragone, G., Mussatto, I. S., Oliveira, M. J., & Teixeira, A. J. (2009). Characterization of volatile compounds in an alcoholic beverage produced by whey fermentation. Food Chemistry, 112(4), 929-935.
Etschmann, M. M. W., Bluemke, W., Sell, D., & Schrader, J. (2002). Biotechnological production of 2-phenylethanol. Applied Microbiology and Biotechnology, 59(4), 1-8.
Etschmann, M. M. W., & Schrader, J. (2006). An aqueous-organic two-phase bioprocess for efficient production of the natural aroma chemicals 2-phenylethanol. Applied Microbiology and Biotechnology, 71(7), 440-443.
Etschmann, M. M. W., Sell, D., & Schrader, J. (2004). Screening of yeast for the productionof the aroma compound 2-phenylethanol in a molasses-based medium. Biotechnology Letters, 25(6), 531-536.
Fabre, C. E., Blanc, P. J., & Goma, G. (1998). Production of 2-phenylethyl alcohol by Kluyveromyces marxianus. Biotechnology Progress, 14(4), 270-274.
Garavaglia, J., Hickmann, F. S., Mara, P. T., Carmo, P. M., & Záchia, A. M. (2007). Bioconversion of L-phenylalanine into 2-phenylethanol by Kluyveromyces marxianus in grape must cultures. World Journal of Microbiology and Biotechnology, 23(5), 1273-1279.
Gupte, A. M., & Nair, J. S. (2010). β- galactosidase production and ethanol fermentation from whey using Kluyveromyces marxianus NCIM 3551. Journal of Scientific & Industrial Research, 69(1), 855- 859.
Hadiyanto, H., Ariyanti, D., Aini, P. A., & Pinundi, D. S. (2014). Optimization of Ethanol Production from Whey Through Fed-Batch Fermentation Using Kluyveromyces marxianus. Energy Procedia, 47(1), 108-112.
Lomascolo, A., Lesage, M. L., Haon, M., Navarro, D., Antona, C., Faulds, C., & Marcel, A. (2001). Evaluation of the potential of Aspergillus niger species for the bioconversion of L-phenylalanine into 2-phenylethanol. World Journal of Microbiology and Biotechnology, 17(1), 99-102.
Mendoza, C. M. E., Rivas, N., Emperatriz, D. B., Delahaye, P., & Bertsch, A. (2006). Obtención y Caracterización de dos concentrados proteicos a partir de biomasa de Kluyveromyces marxianus var. marxianus cultivada en suero lácteo desproteinizado. Revista Científica, FCV-LUZ, 16(3), 315-324.
Mihal, M., Krištofíková, L., & Marcŏs J. (2013). Production of 2-phenylethanol in hybrid system using airlift reactor and immersed hollow fiber membrane module. Chem Eng Process, 72(1), 144-52.
Mollea, C., Marmo, L. & Bosco, F. (2013). Valorisation of Cheese Whey, a By-Product from the Dairy Industry. In tech, 24(1), 549-556
Páez, G., Pérez, A., Araujo, A., Mármol, Z., & Rincón, M. (2012). Effect of lactose concentration over β-D-galactosidase production by Kluyveromyces marxianus ATCC 8554 in fed batch cultures. Revista de la Sociedad Venezolana de Microbiología, 32(1), 50-54.
Páez, L. J. B., Arias, G. G., Rutiaga, Q. M., Barrio, E., & Soto, C. O. (2013). Yeast Isolated from the Alcoholic Fermetation of Agave duranguensis During Mezcal Production. Food biotechnology, 27(1), 342-356.
Parra, H. R. A. (2009). Lactosuero: importancia en la industria de alimentos. Revista Facultad Nacional de Agronomía Medellin, 62(1), 4967-4982.
Prazeres, A. R., Carvalho, F., & Rivas, J. (2012). Cheese whey management: A review. Journal of Environmental Management, 110(3), 48-68.
Prazeres, A. R., Carvalho, F., & Rivas, J. (2013). Fenton-like application to pretreated cheese whey wastewater. Journal of Environmental Management, 129(1), 199-205.
Prudêncio, S., Müller, C., Fritzen-Freire, B., Castanho, R., & Cunha, C. (2014). Effect of whey nanofiltration process combined with diafiltration on the rheological and physicochemical properties of ricotta cheese. Food Research International, 56(1), 92-99.
Singh, D., Nigam, P., Banat, I. M., Marchant, R., & McHale, A. P. (1998). Review: Ethanol production at elevated temperatures and alcohol concentrations. Part II. Use of Kluyveromyces marxianus IMB3. World Journal of Microbiology and Biotechnology, 14(2), 823-834.
Smithers, G. W. (2008). Whey and whey proteins-from gutter to gold. International Dairy Journal, 18(4), 695-704.
Spălățelu, C. (2012). Biotechnological valorisation of whey. Innovative Romanian Food Biotechnology, 10(1), 1-8.
Stark, D., Münch, T., Sonnleitner, B., Marison, I. W., & Von Stockar, U. (2003). Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae. Biotechnol Prog, 18(3), 514-523.
Valencia, E., & Ramírez, M. (2009). La industria de la leche y la contaminación del agua. Revista Elementos, 73(3), 27-31.
Wittmann, C., Hans, M., & Bluemke, W. (2002). Metabolic physiology of aroma-producing Kluyveromyces marxianus. Yeast, 19(15), 1351-1363.
Yadav, J. S. S., Bezawada, J., Ajila, C. M., Yan, S.,Tyagi, R. D., & Surampalli, R. V. (2014). Mixed culture of Kluyveromyces marxianus and Candida krusei for single-cell protein production and organic load removal from whey. Bioresource Technology, 164(6), 119-127.
Zhou, X. H., Xu, L. J., Chi, Z., Liu, L. G., & Chi, M. Z. (2013). β-Galactosidase over-production by mig1 mutant of Kluyveromyces marxianus KM for efficient hydrolysis of lactose. Biochemical Engineering Journal, 76(2), 17-24.
Zwietering, M. H., Jongenburger, I., Rombouts, F. M., & Van`t, R. (1990). Modeling of the Bacterial Growth Curve. Applied and Environmental Microbiolgy, 56(6), 1875-1881.