RESUMEN
Los envenenamientos por mordeduras de serpientes de cascabel son de importancia médica. Los diversos factores que la medicina atiende son el clima, la edad, el sexo, la distribución, la época del año y el régimen alimenticio, ya que éstos hacen que las serpientes sean más venenosas y tóxicas. El objetivo del presente trabajo es proporcionar información acerca de la variación estacional del contenido proteico y el daño hemolítico producido por el veneno de Crotalus molossus molossus en cautiverio y en vida silvestre. Para ello, se analizaron 16 muestras de veneno por medio de un método colorimétrico y visualizadas por electroforesis en gel de poliacrilamida con dodecil sulfato sódico (SDS-PAGE por sus siglas en inglés). La actividad hemolítica de la fosfolipasa A2 (PLA2) fue evaluada en placas de agar-eritrocitos. Se observó una gran variación en el contenido proteico de los venenos de las serpientes en cautiverio y en vida silvestre, donde sobresale la pool de invierno de vida silvestre, la cual presentó una mayor concentración de 697 µg/µl ± 5.9 µg/µl, seguido por el pool de otoño en cautiverio (648 µg/µl) ± 20.8 µg/µl), el pool de primavera en cautiverio (528.51 µg/µl ± 10.59 µg/µl) y el pool de verano en cautiverio con 387.9 µg/µl ± 5.6 µg/µl. Se purificó la PLA2 del veneno observándose en las fracciones independientes 27, 39, 26 y 27 (n=60) de primavera, verano, otoño e invierno, respectivamente. La muestra de otoño presentó mayor actividad hemolítica y la de invierno la de menor actividad. Finalmente, las muestras de veneno de las serpientes mantenidas en cautiverio presentaron mayor concentración en comparación con las de vida silvestre, así como también se observaron variaciones con la actividad hemolítica de acuerdo con la época del año.
ABSTRACT
Envenomation by rattlesnake bites is medical imperative. Medicine focuses on diverse factors such as climate, age, sex, distribution, season of the year and diet, as these make the snake’s venom more poisonous and toxic. The objective of this study is to provide information on the seasonal variation of the protein content and hemolytic damage of the venom produced by captive and wild Crotalus molossus molossus. For this, we analyzed 16 samples of venom using the colorimetric method and visualized by Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis (SDS-PAGE). The hemolytic activity of the phospholipase A2 (PLA2) was evaluated on erythrocytes-agar plates.We observed a large variation in the protein content between captive and wild snake venom; the winter pool of wild snake venom stands out with the highest concentration at 697 µg/µl ± 5.9 µg/µl, followed by the autumn pool in captivity with 648 µg/µl ± 20.8 µg/µl, the spring pool in captivity 528.51 µg/µl ± 10.59 µg/µl, and, lastly, the summer pool in captivity 1 with 387.9 µg/µl ± 5.6 µg/µl. The PLA2 was purified from the venom obtained from independent fractions 27, 39, 26, and 27 (n=60) of spring, summer, autumn and winter, respectively. The autumn sample showed higher hemolytic activity and the lowest activity was shown in the winter sample. We conclude that venom samples from captive rattlesnakes showed higher concentrations of protein compared to samples from wild snakes, in addition there were variations in the hemolytic activity according to the time of year.
Uno de los objetos de interés en el área de la salud pública son los envenenamientos generados por la mordedura de las serpientes de cascabel (Rael, Rivas, Chen, Maddux, Huizar & Lieb, 1997). Los diversos factores como el clima, la edad, el sexo, la distribución, las estaciones del año y el régimen alimenticio de las serpientes hacen que éstas sean más venenosas y tóxicas (Forstner, Hilsenbeck & Scudday, 1997; Gómez, 2000). Se ha observado que de acuerdo con el tipo de hábitat que presenten las serpientes y de la misma especie, el veneno se comporta de diferente manera (French, Hayes, Bush, Cardwell, Bader & Rael, 2004). Crotalus molossus molossus es la serpiente de cascabel conocida comúnmente como víbora de cascabel de cola negra (Campbell & Lamar, 2004; Lemos-Espinal & Smith, 2007). Esta serpiente es menos venenosa que otras de su género, pero sí llega a presentar un daño grave a los seres humanos provocando lesiones, que van desde hemorragias, necrosis en el área de la mordida, pérdida de la extremidad afectada hasta la muerte (Sánchez, Solís, Ramírez & Pérez, 2001). El veneno de esta serpiente, constituido por enzimas, proteínas y toxinas, actúa sobre la sangre destruyendo los glóbulos rojos y el tejido muscular, y como daño secundario actuando sobre el sistema nervioso (Gómez, 2000). De acuerdo con diversos estudios de variación del contenido proteico en venenos de serpientes, se ha observado que se presentan variaciones de concentración, teniendo serpientes en cautiverio y modulando la temperatura, simulando las diferentes estaciones; además, se ha observado que existen diferencias entre concentración de proteína (Gregory-Dwyer, Egen, Bosisio, Righetti & Russell, 1986). López-Lozano et al. (2002) compararon el veneno de ejemplares juveniles, semiadultos y adultos de Bothrops atrox, que fueron colectados en la región de Manaus en Brasil, observando que el veneno de los juveniles y semiadultos presentaron una mayor actividad anticoagulante que los adultos. Galán, Sánchez, Rodríguez-Acosta & Pérez (2004) neutralizaron el veneno de la serpiente Crotalus helleri de dos localidades diferentes, una del sureste de California, Estados Unidos (EUA), y otra del norte de Baja California, México, las cuales presentaron diferencias en el veneno, tanto en la concentración proteica como en el color. Por otra parte, se ha analizado la actividad enzimática y hemolítica que producen los venenos de los vipéridos, especialmente con la fosfolipasa A2 (PLA2), miotoxicidad, neurotoxicidad y la letalidad del veneno (Bonilla & Zavaleta, 1997). Así, el propósito fundamental de esta investigación es la de proporcionar información acerca de la variación estacional del contenido proteico y el daño hemolítico del veneno total de la serpiente Crotalus molossus molossus durante las cuatro estaciones del año, tanto en cautiverio como en vida silvestre, para poder predecir la peligrosidad y toxicidad de su veneno. Ello debido a que existe poca información sobre el efecto hemolítico que causa el veneno de las serpientes en la región norte del país, infiriendo que haya una relación con el contenido proteico y las estaciones del año.
MATERIALES Y MÉTODOS
Muestreo y colecta de veneno
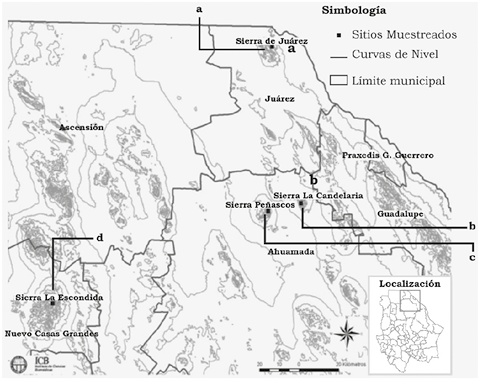
Se realizó un estudio entre el otoño de 2006 hasta finalizar el invierno a principios del 2008, realizando un total de 11 salidas (dos en primavera, tres en verano, tres en otoño y tres en invierno), de las cuales se colectaron siete serpientes silvestres y dos serpientes en cautiverio, obteniendo un total de 16 muestras de veneno. Dichos muestreos se realizaron en cuatro localidades del estado de Chihuahua, México (figura 1). El veneno se extrajo con la ayuda de un gancho herpetológico; se tomó la cabeza sujetando el cuello e induciendo la mordedura sobre un vaso de precipitado de 200 ml tapado con papel Parafilm® en el Laboratorio de Ecología y Biodiversidad Animal (LEBA) de la Universidad Autónoma de Ciudad Juárez (UACJ). Una vez colectado el veneno, se colocó en un microtubo de plástico de 1.5 ml cerrado herméticamente, y se mantuvo almacenado a -20 ˚C en el Laboratorio de Biología Molecular y Bioquímica (LBMB) de la UACJ. El veneno colectado por espécimen fue manejado como volumen total (pool), y se tomó en consideración su futura dilución para evitar perder los datos de actividad bioquímica del veneno por estación del año. Esto fue debido a la limitada colecta de ejemplares por estación del año. El color del veneno se caracterizó por la turbidez que presentó y la presencia de la proteína L aminoácido oxidasa (LAO) (Galán et al., 2004). Debido a cuestiones de seguridad, los ejemplares fueron manipulados en el LEBA. La preservación de las muestras y el análisis bioquímico se realizaron en el LBMB.
|
| |
 |
 |
Figura 1. Localización de los sitios de colectas en el estado de Chihuahua, México (situado en las coordenadas 28° 30' de latitud norte y de 10° 00' de longitud oeste, colindando con el estado de Texas (EUA). Donde: (a) Sierra Juárez con coordenadas de 31˚ 44’ de latitud norte y 106˚ 29’ longitud oeste; (b) Sierra La Candelaria a 31˚ 02’ latitud norte y 106˚ 25’ longitud oeste; (c) Sierra Peñascos a 31˚ 00’ latitud norte y 106˚ 30’ latitud oeste; y (d) Sierra La Escondida a 30˚ 35’ de latitud norte y 107˚ 40’ de longitud oeste. En el mapa de la República mexicana se señala la región donde se encuentra el estado de Chihuahua.
Fuente: www.mapresources.com |
 |
 |
Figura 1. Localización de los sitios de colectas en el estado de Chihuahua, México (situado en las coordenadas 28° 30' de latitud norte y de 10° 00' de longitud oeste, colindando con el estado de Texas (EUA). Donde: (a) Sierra Juárez con coordenadas de 31˚ 44’ de latitud norte y 106˚ 29’ longitud oeste; (b) Sierra La Candelaria a 31˚ 02’ latitud norte y 106˚ 25’ longitud oeste; (c) Sierra Peñascos a 31˚ 00’ latitud norte y 106˚ 30’ latitud oeste; y (d) Sierra La Escondida a 30˚ 35’ de latitud norte y 107˚ 40’ de longitud oeste. En el mapa de la República mexicana se señala la región donde se encuentra el estado de Chihuahua.
Fuente: www.mapresources.com Close |
Análisis del contenido proteico
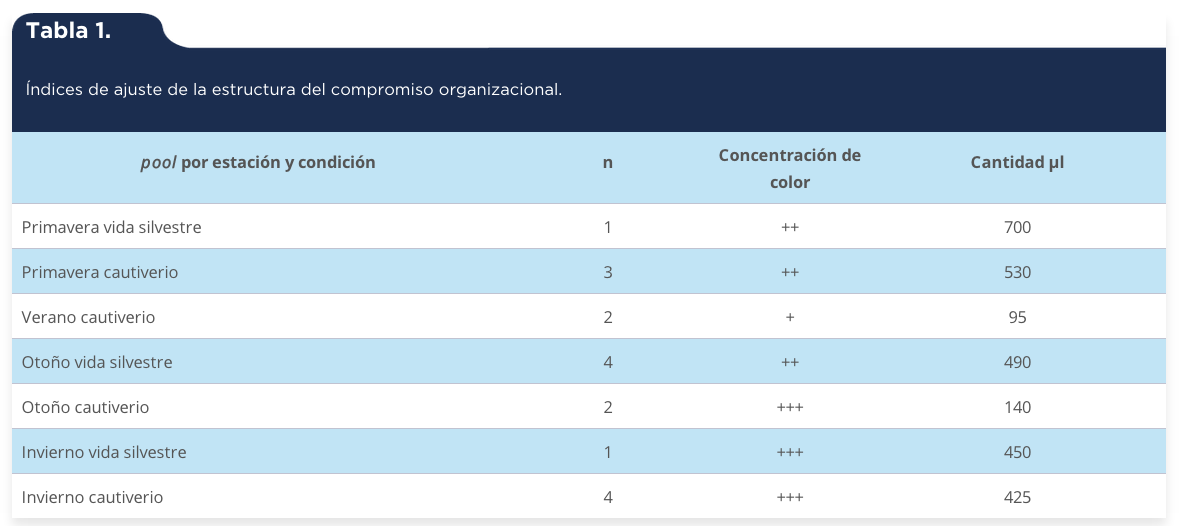
El contenido proteico de 16 muestras conformando siete pool de veneno de Crotalus molossus molossus (tabla 1) se determinó por el método de Lowry, Rosebrough, Farr & Randall (1951), usando albúmina sérica bovina (BSA) como curva patrón.
Visualización del contenido proteico
Se analizaron un total de 16 muestras de veneno que fueron sometidas de manera individual a electroforesis desnaturalizante en placa según el método de Laemmli (1970). Para ello se utilizaron geles de poliacrilamida al 10% o 15% (p/v) formados en presencia de dodecil sulfato de sodio (SDS por sus siglas en inglés) y un sistema Mini-Protean III de Bio-Rad (Estados Unidos). La electroforesis se realizó a voltaje constante de 120 V por espacio de 90 min y a temperatura ambiente, usando como marcadores de masa molecular miosina (215 kDa), fosforilasa b (120 kDa), albúmina de suero bovino (84 kDa), albúmina de huevo (60 kDa), anhidrasa carbónica (39.2 kDa), inhibidor de tripsina (28 kDa) y lisozima (18.3 kDa).
Fraccionamiento del veneno
El veneno fue eluido (1:10) en solución amortiguadora de fosfato de potasio dibásico, y fue aplicado a una columna de 90 cm ´ 1.8 cm de gel Sephadex G-75 (Sigma) superfino, calibrado a temperatura ambiente con amortiguador de fosfato de potasio dibásico (F.W. 174.18, pH 8.4, al 98%), manejando a flujo constante de 22.22 ml/h. Las fracciones eluidas (1.5 ml/tubo) fueron colectadas manualmente en tubos individuales y fueron cuantificadas espectrofotométricamente a una absorbancia de 280 nm, de acuerdo con Bonilla & Zavaleta (1997).
Determinación de la masa molecular aparente
La masa molecular aparente de las fracciones fue estimada mediante filtración en gel Sephadex G-75 (Sigma) y electroforesis vertical en gel de poliacrilamida. Para la electroforesis las fracciones de interés fueron analizadas en gel de poliacrilamida al 15% en las condiciones descritas anteriormente.
Actividad hemolítica
La actividad hemolítica fue ensayada bajo el método descrito por Bonilla & Zavaleta (1997) en eritrocitos humanos obtenidos de donadores Rh A positivos, los cuales fueron mantenidos en suspensión con amortiguador glicina-NaCl (glicina 0.1 M en cloruro de sodio al 0.6%) a pH 5.8. La actividad hemolítica fue evaluada por el método siguiente:
• Hemolisis en placa de agar
Unidades de hemolisis directa en placa (UHD). Se realizó una mezcla en partes iguales de agar (invitrogen UltraPureTM) de alta electroendosmosis al 1% (p/v) y agar (invitrogen UltraPureTM) de baja electroendosomosis al 1% (p/v) con amortiguador acetato de sodio 0.05 M a pH 7.5 calentada a 40 °C para disolver el agar. Posteriormente se dejó enfriar la mezcla y se adicionaron 2 ml de eritrocitos previamente lavados en solución Gly 0.1 M/NaCl 0.6% (p/v). La mezcla fue vertida en placas de Petri. Luego de la polimerización se realizaron orificios de 1.5 mm de diámetro en el gel para adicionar 5 µl de veneno, adicionando la misma cantidad de solución salina como control. Las muestras fueron incubadas a 37 °C, por periodos variables de tiempo (0 min-120 min), midiéndose posteriormente el diámetro (mm) del halo producido con un Vernier. Se calcula con la siguiente fórmula:

Actividad de fosfolipasa
Se midió por medio de análisis de placa bajo el protocolo descrito por Habermann & Hardt (1972) y citado por Bonilla & Zavaleta (1997), que mide la formación de un halo claro producto de la hidrólisis de la lecitina por la fosfolipasa. Se preparó una placa de agar yema de huevo (85%) para realizar la actividad de la fosfolipasa, en donde una unidad de actividad fosfolipásica (UF) en placa se expresa como la cantidad de proteína capaz de lisar 1 mm de gel en 1 h de incubación. Se determinó mediante la fórmula:
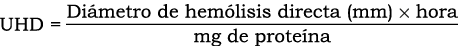
Análisis estadístico
El análisis estadístico se realizó por medio del programa Minitab 15, usando la prueba no paramétrica Mann Whitney para determinar las diferencias estadísticas a un IC95. Las gráficas fueron obtenidas por el programa SigmaPlot® V. 11.
RESULTADOS
Caracterización visual del veneno
Se obtuvieron un total de 16 muestras de veneno correspondientes a nueve serpientes de cascabel en el periodo señalado, en metodología de estudio correspondiendo a siete pool de veneno, obteniendo diferentes concentraciones y volúmenes de veneno (tabla 1). El promedio del volumen total del veneno extraído fue de 404.28 μl. El 14.28% de las muestras presentaron un patrón de coloración amarillo claro (+), el color amarillo leve (++) y el amarillo intenso (+++), con un 42.85% cada uno.
Tabla 1.
Índices de ajuste de la estructura del compromiso organizacional.
|
|
pool por estación y condición
|
n
|
Concentración de color
|
Cantidad µl
|
|
Primavera vida silvestre
|
1
|
++
|
700
|
|
Primavera cautiverio
|
3
|
++
|
530
|
|
Verano cautiverio
|
2
|
+
|
95
|
|
Otoño vida silvestre
|
4
|
++
|
490
|
|
Otoño cautiverio
|
2
|
+++
|
140
|
|
Invierno vida silvestre
|
1
|
+++
|
450
|
|
Invierno cautiverio
|
4
|
+++
|
425
|
Fuente: Elaboración propia. Abrir
 |
Fuente: Elaboración propia. Close |
Concentración proteica de veneno en las estaciones del año
Se observó la variación proteica de los venenos de las diferentes serpientes en las estaciones del año, bajo las condiciones de cautiverio y vida silvestre, siendo el pool de invierno en vida silvestre el que presentó mayor concentración (697 µg/µl ± 5.7 µg/µl), seguido por el pool de otoño en cautiverio (648 µg/µl ± 20.8 µg/µl), el pool de primavera en cautiverio (528.51 µg/µl ± 10.59 µg/µl) y el pool de verano en cautiverio con 387.9 µg/µl ± 5.6 µg/µl. Se puede observar una diferencia entre las concentraciones proteicas entre los pool de las diferentes estaciones del año, aunque no son significativamente diferentes de acuerdo con la prueba no paramétrica de Mann Whitney, dando un valor de p > 0.05 a un Índice de Confianza (IC) 95% (figura 2).
|
| |
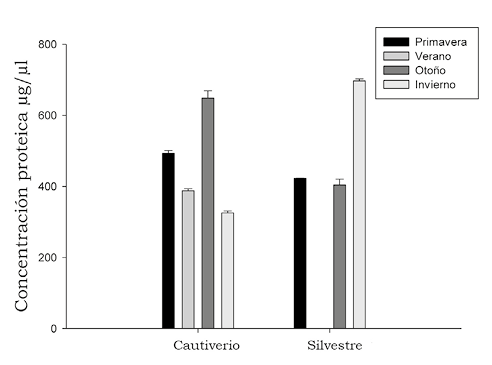 |
Figura 2. Variación de la concentración proteica de los pool de los venenos en las diferentes estaciones del año.
Fuente: Elaboración propia. |
 |
Figura 2. Variación de la concentración proteica de los pool de los venenos en las diferentes estaciones del año.
Fuente: Elaboración propia. Close |
Visualización del contenido proteico en electroforesis SDS-PAGE
En los carriles se depositó una cantidad estándar de 80 μg de proteína (figura 3a), obteniendo una variabilidad de bandas de proteínas en las diferentes épocas del año, donde se puede observar que las serpientes que se encuentran en cautiverio presentan patrones de bandas más densos cuando se comparan con las de vida silvestre, excepto la obtenida en invierno en vida silvestre, la cual presentó mayor densidad de bandas comparada con las de cautiverio (figura 3b).
|
| a) |
 |
| b) |
|
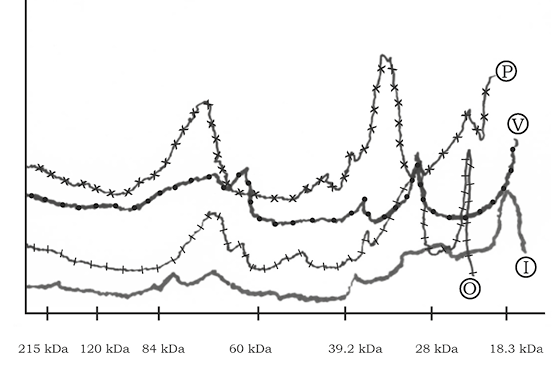 |
Figura 3. a) Visualización de todos los venenos de manera individual por medio de SDS-PAGE, donde se puede observar los diferentes tipos de bandas proteicas, donde sobresalen dos bandas principales de 72 kDa y de 29 kDa, un patrón de marcaje que se repite en las muestras de todas las épocas del año. Sobresalen también las muestras de cautiverio en las épocas de primavera, verano y otoño. En invierno, la muestra de vida silvestre se observó con mayor patrón de densidad la banda de 29 kDa en comparación con las de cautiverio. b) Densitometría de las muestras del veneno de la serpiente C. molossus molossus donde se observa que la proteína de 72 kDa presenta una mayor densidad en la época de primavera (P) y la de 29 kDa resalta en un pico con menor densidad. En verano (V) estas proteínas se encuentran en una menor densidad, y sobresaliendo el pico más alto en la de 29 kDa. En otoño (O) se encuentra con mayor densidad la proteína de 29 kDa, y sobresale un pico en una de menor densidad de masa molecular. En invierno (I) la proteína de 72 kDa se presenta disminuida en comparación con las otras estaciones del año, en cambio la de 29 kDa se presenta con mayor densidad.
Fuente: Elaboración propia. |
 |
Figura 3. Variación de la concentración proteica de los pool de los venenos en las diferentes estaciones del año.
Fuente: Elaboración propia. Close |
 |
Figura 3. Variación de la concentración proteica de los pool de los venenos en las diferentes estaciones del año.
Fuente: Elaboración propia. Close |
Fraccionamiento del veneno
Se colectaron 60 fracciones individuales de la columna de Sephadex G-75, obteniendo distintos valores de absorbancia en cada fracción correspondiente a cada estación del año. Se observó que los picos de mayor concentración están de la fracción 12 a la 31 sin importar la época estacional (figura 4).
|
| |
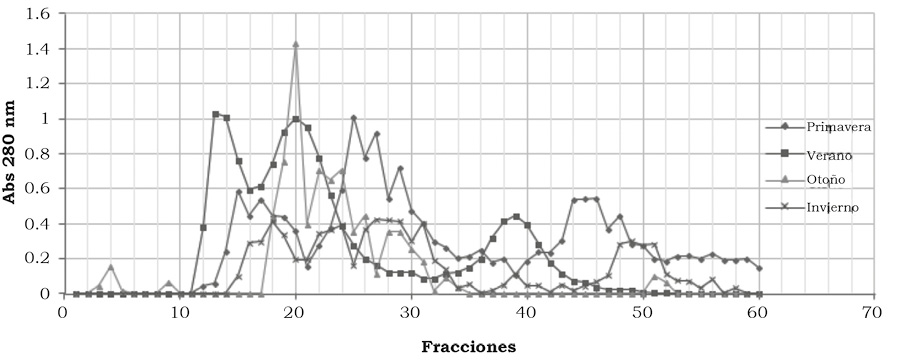 |
Figura 4. Cromatograma de las absorbacias (Abs) a 280 nm del contenido proteico del veneno de C. molossus molossus por estaciones del año con una cantidad de veneno diluido (1:10). Las líneas horizontales hacen más fácil la observación de los picos más altos y, por tanto, la identificación del nivel más alto en la estación de otoño.
Fuente: Elaboración propia. |
 |
Figura 4. Cromatograma de las absorbacias (Abs) a 280 nm del contenido proteico del veneno de C. molossus molossus por estaciones del año con una cantidad de veneno diluido (1:10). Las líneas horizontales hacen más fácil la observación de los picos más altos y, por tanto, la identificación del nivel más alto en la estación de otoño.
Fuente: Elaboración propia. Close |
Vizualización de la masa molecular aparente
En la figura 5 se pueden observar las fracciones purificadas donde en el carril 1 se depositó la muestra de veneno crudo: carril 6 y 7, la visualización de la PLA2 en fracciones 24 y 26, respectivamente, y carril 10, marcador de masa molecular.
|
| |
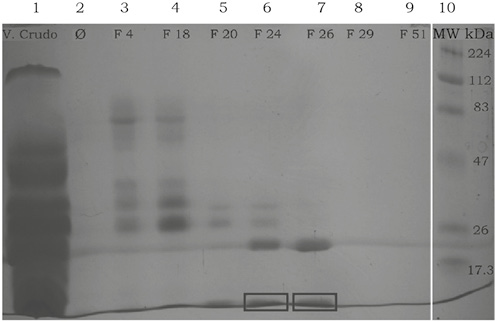 |
Figura 5. Visualización de las fracciones de otoño obtenidas por cromatografía en gel de Sephadex G-75 en SDS-PAGE al 15% (p/v).
Fuente: Elaboración propia. |
 |
Figura 5. Visualización de las fracciones de otoño obtenidas por cromatografía en gel de Sephadex G-75 en SDS-PAGE al 15% (p/v).
Fuente: Elaboración propia. Close |
La observación de la PLA2 de la muestra de primavera (a) se visualizó en el carril 1 y 3, correspondiente a las fracciones 29 y 27. En los carriles 2 y 4 presentaron bandas, pero no se logró identificar la presencia de la PLA2. En verano (b) en el carril 8 se identificó la PLA2 fracción 39. Para invierno (c) se observó la PLA2 en el carril 10 correspondiente a la fracción 27 (figura 6).
|
| |
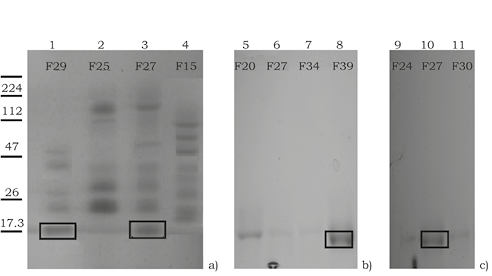 |
Figura 6. Visualización aparente de la PLA2 por medio de SDS-PAGE al 15% (p/v).
Fuente: Elaboración propia. |
 |
Figura 6. Visualización aparente de la PLA2 por medio de SDS-PAGE al 15% (p/v).
Fuente: Elaboración propia. Close |
Hemolisis por el veneno crudo en placa de agar
Se realizaron placas de agar-eritrocitos de humano perteneciente a cada estación del año (figura 7). La actividad hemolítica del veneno crudo de Crotalus molossus molossus se evaluó a las 2 h, donde se observó una variación en el diámetro del halo hemolítico, con una cantidad uniforme en volumen de 5 µl para cada estación del año. Para la muestra de primavera se observó un halo hemolítico de 9 mm con una unidad de hemolisis directa (UHD) de 1.88 (panel a); la muestra de verano presentó un halo hemolítico de 7 mm y UHD de 1.69 (panel b); en otoño se observó un halo de 8 mm y una UHD de 1.43 (panel c) y en invierno un halo hemolítico de 6 mm con una UHD de 1.54 (panel d), respectivamente.
|
| a) |
 |
b) |
 |
| c) |
 |
d) |
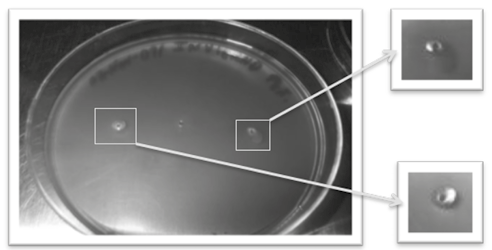 |
Figura 7. Análisis del grado de hemolisis por la PLA2 del veneno crudo en geles de agar-eritrocitos de humano. Paneles: a) primavera 9 mm de diámetro; b) verano 7 mm de diámetro; c) otoño 8 mm de diámetro; d) invierno 6 mm de diámetro. El control negativo presentó un diámetro de 0 mm, debido a que se utilizó una solución de PBS 1X (Na2HPO4 4.3 mM, NaCl 137 mM, KCl 2.7 mM y KH2PO4 1.4 mM a un pH de 7.4 en agua desionizada).
Fuente: Elaboración propia. |
 |
Figura 7. Análisis del grado de hemolisis por la PLA2 del veneno crudo en geles de agar-eritrocitos de humano. Paneles: a) primavera 9 mm de diámetro; b) verano 7 mm de diámetro; c) otoño 8 mm de diámetro; d) invierno 6 mm de diámetro. El control negativo presentó un diámetro de 0 mm, debido a que se utilizó una solución de PBS 1X (Na2HPO4 4.3 mM, NaCl 137 mM, KCl 2.7 mM y KH2PO4 1.4 mM a un pH de 7.4 en agua desionizada).
Fuente: Elaboración propia. Close |
 |
Figura 7. Análisis del grado de hemolisis por la PLA2 del veneno crudo en geles de agar-eritrocitos de humano. Paneles: a) primavera 9 mm de diámetro; b) verano 7 mm de diámetro; c) otoño 8 mm de diámetro; d) invierno 6 mm de diámetro. El control negativo presentó un diámetro de 0 mm, debido a que se utilizó una solución de PBS 1X (Na2HPO4 4.3 mM, NaCl 137 mM, KCl 2.7 mM y KH2PO4 1.4 mM a un pH de 7.4 en agua desionizada).
Fuente: Elaboración propia. Close |
 |
Figura 7. Análisis del grado de hemolisis por la PLA2 del veneno crudo en geles de agar-eritrocitos de humano. Paneles: a) primavera 9 mm de diámetro; b) verano 7 mm de diámetro; c) otoño 8 mm de diámetro; d) invierno 6 mm de diámetro. El control negativo presentó un diámetro de 0 mm, debido a que se utilizó una solución de PBS 1X (Na2HPO4 4.3 mM, NaCl 137 mM, KCl 2.7 mM y KH2PO4 1.4 mM a un pH de 7.4 en agua desionizada).
Fuente: Elaboración propia. Close |
 |
Figura 7. Análisis del grado de hemolisis por la PLA2 del veneno crudo en geles de agar-eritrocitos de humano. Paneles: a) primavera 9 mm de diámetro; b) verano 7 mm de diámetro; c) otoño 8 mm de diámetro; d) invierno 6 mm de diámetro. El control negativo presentó un diámetro de 0 mm, debido a que se utilizó una solución de PBS 1X (Na2HPO4 4.3 mM, NaCl 137 mM, KCl 2.7 mM y KH2PO4 1.4 mM a un pH de 7.4 en agua desionizada).
Fuente: Elaboración propia. Close |
Actividad de PLA2 del veneno fraccionado
En la muestra de primavera se observó un halo hidrolítico de 9 mm con una unidad de fosfolipasa (UF) de 3.76; para verano se observó una hidrólisis de 7 mm con 3.38 UF; para otoño aumentó a 8 mm la hidrólisis y presentó una UF de 2.87; y para invierno disminuyó, siendo la actividad más baja con 6 mm de diámetro con una UF de 3.07 (figura 8).
|
| |
 |
Figura 8. Análisis de la actividad de PLA2 pura en placa de agar-yema de huevo y determinación de los halos de hidrólisis durante las diferentes épocas del año. Paneles: a) primavera, b) verano, c) otoño y d) invierno.
Fuente: Elaboración propia. |
 |
Figura 8. Análisis de la actividad de PLA2 pura en placa de agar-yema de huevo y determinación de los halos de hidrólisis durante las diferentes épocas del año. Paneles: a) primavera, b) verano, c) otoño y d) invierno.
Fuente: Elaboración propia. Close |
DISCUSIÓN
En las muestras analizadas de la estación de primavera se observaron diferentes bandeos de proteínas por medio de electroforesis SDS-PAGE, así como del mismo patrón de bandas más marcadas de las muestras de veneno de las otras estaciones del año (verano, otoño e invierno). También se logró observar la presencia de degradación de una proteína de aproximadanmente 72 kDa de las muestras de otoño (figura 3a), lo cual suponemos que al repetirse ese mismo patrón en la misma estación y de dos serpientes diferentes pueda deberse a la misma actividad proteasa del veneno o por el proceso de preservación de la muestra, siendo el primer caso el más aceptado, ya que las muestras fueron tratadas de la misma forma. A este respecto, López-Lozano et al. (2002) encontraron variaciones de concentración proteica y actividad proteolítica que fue dependiente de la temperatura y del pH (López-Lozano et al., 2002). De las muestras de verano, la de cautiverio presentó esa misma banda proteica de 72 kDa aún más concentrada que la de vida silvestre y que fue considerada posteriormente como de cautiverio por conservarse más de dos meses en el LEBA. Dentro del otoño, las muestras de vida silvestre presentaron mayor diversidad de proteínas en comparación con las de cautiverio (figura 3a), siendo nuevamente la proteína de 72 kDa la que se presentó en todas las muestras, además de visualizar una proteína de 29 kDa que con su masa podría corresponder a la metaloproteinasa hemorrágica (Sánchez et al., 2001). Las serpientes de cautiverio presentaron bandas diferentes de menor masa molecular. En invierno, las muestras mostraron menor densidad de masa en las proteínas de 72 kDa y 29 kDa, quizás por la baja disponibilidad de alimento y las bajas temperaturas propias de la estación (figuras 3a y 3b). En este caso, sólo se colectó una muestra de veneno en vida silvestre, la cual presentó una gran densidad de masa en la banda que corresponde a los 29 kDa. Ello en comparación con las de cautiverio, las cuales se presentaron menor cantidad de bandas de proteínas. Dependiendo del color del veneno se ha observado que varía la concentración de las proteínas, donde el color amarillo es más tóxico en comparacion con el de color claro (Galán et al., 2004). Se tiene reportado que la variación del contenido proteico de Crotalus molossus molossus depende también de su distribución geográfica, por medio de la actividad fibrolítica; esto hace que la variabilidad del veneno sea de importancia médica (Rael et al., 1997). Gregory-Dwyer et al., (1986) mencionan que en los accidentes con vipéridos no observaron diferencia significativas en los venenos de Crotalus atrox, donde la mayor producción de veneno es en los meses de julio-octubre, y el cambio de la dosis letal media (LD50) se presenta en los meses de abril-agosto. Forstner et al. (1997), analizando el veneno de Crotalus lepidus lepidus, observaron que de acuerdo con la distribución geográfica, el veneno presentaba variaciones en un rango de toxicidad de 2.20 mg/kg-0.70 mg/kg.
Respecto del análisis de hemolisis en placa de agar-eritrocitos con el veneno crudo de Crotalus molossus molossus, en las diferentes estaciones del año se logró observar que se presentó diferente daño hemolítico en comparación con lo reportado por Bonilla & Zavaleta (1997), en el que usando veneno de Bothrops sp. no presentó daño hemolítico con veneno crudo, pero sí de tipo fosfolipasa. Con respecto a los valores del diámetro en milímetros de los halos hemolíticos (entre 6 mm y 9 mm) hubo una diferencia significativa entre las cuatro estaciones del año, sin embargo, los valores obtenidos para las UHD fueron relativamente similares (entre 1.43-1.88), ello tomando en cuenta que se utilizó el mismo volumen de veneno crudo para todos los experimentos. Esto se puede explicar desde el punto de vista de la concentración nativa de proteína contenida en las distintas muestras, donde entre mayor es la cantidad de proteína, mayor es el grado hemolítico causado (figura 7); es decir, está actuando un mismo conjunto particular de enzimas degradativas, entre ellas principalmente la fosfolipasa, como a su vez las metaloprotinasas tipo I, tipo III y serin proteasas sobre las biomembranas celulares de los eritrocitos de humano.
De la cromatografía por filtración en gel Sephadex G-75 se obtuvieron un total de 60 fracciones de cada estación del año. Se observó que en el rango de las fracciones 15-35 presentaron actividad hidrolítica del tipo fosfolipasa A2 (figura 8). Otros estudios, donde se utilizó Sphadex G-100, separaron todas las fracciones del filtrado en tres conjuntos, en las cuales observaron actividad hemolítica y del tipo fosfolipasa en la fraccion II del pico (Bonilla & Zavaleta, 1997). Por su parte, Alagón, Molinar, Possani, Fletcher, Cronan & Julia (1980) lograron obtener siete fracciones de diferentes masas moleculares, donde la fraccion 2 y 3 presentaron la actividad fosfolipasa. En este caso, las fracciones presentaron una masa molecular dentro del rango de 14 kDa-17 kDa, las cuales fueron visualizadas por medio de geles de poliacrilamida (SDS-PAGE) al 15%. La PLA2 en primavera presentó una masa molecular de 17 kDa en la fracción 27 y 29, para verano se colectó en la fracción 39 con una masa molecular de 15 kDa, en otoño en la fracción 24, con la misma masa molecular, y en invierno presentó una masa molecular de 14 kDa en la fracción 27. Estos valores fueron muy cercanos, las pequeñas diferencias en masa molecular pudieron deberse simplemente a las cantidades y concentraciones del veneno por las diferentes estaciones del año, y donde también depende el tipo de columna utilizado por nosotros y por los autores mencionados.
CONCLUSIONES
Se logró observar que las serpientes en estado de cautiverio presentaron mayor concentración del veneno en comparación con las que se colectaron en campo.
La estación de otoño fue donde se encontró mayor concentración de proteínas totales de los venenos por estación del año, determinando que fue la concentración más elevada en comparación con su contraparte de las muestras del invierno, así como las comparadas de entre primavera y verano.
Con base en los experimentos realizados, acerca de la purificación de las muestras de veneno y caracterización de la masa molecular aparente de la enzima PLA2 en cada una de las diferentes estaciones se concluye que existen variaciones en las concentraciones de proteínas, volúmen de extracción de veneno del ejemplar, su hemolisis e hidrólisis PLA2 en placa y su actividad in vitro y sobre un sustrato sólido artificial del veneno de la serpiente Crotalus molossus molossus en cada una de las estaciones del año.
AGRADECIMIENTOS
Al Departamento de Ciencias Químico-Biológicas de la Universidad Autónoma de Ciudad Juarez. Proyecto interno registrado como SF-CGIP 2009. Permiso de colecta ante la DGVS/Semarnat y Conabio Proyecto GT032. Se agradece a Nora Reyes Villegas por la elaboración del mapa.
REFERENCIAS
Alagón, A. C., Molinar, R. R., Possani, L. D., Fletcher, P.L. Jr., Cronan, J. E. Jr. & Julia, J. Z. (1980). Venom from the snake Bothrops asper Garman. Purification and characterization of three phospholipases A2. Biochemical Journal, 185(3), 695-704.
Bonilla, C. & Zavaleta, A. (1997). Estudio bioquímico del veneno de la serpiente Bothrops hyoprorus. Revista Peruana de Medicina Experimental y Salud Pública, XIV(2), 18-32.
Campbell, J. & Lamar, W. (2004). Regional accounts & keys to venomous snakes- Mexico & Central America. In J. A. Campbell & W. W. Lamar (Eds.), The venomous reptiles of Latin America. USA: Cornell University Press, Ithaca.
Forstner, M., Hilsenbeck, R. & Scudday, J. (1997). Geographic Variation in Whole Venom Profiles from the Mottled Rock Rattlesnake (Crotalus lepidus lepidus) in Texas. Journal of Herpetology, 31(2), 277-287.
French, W., Hayes, W., Bush, S., Cardwell, M., Bader, J. & Rael, E. D. (2004). Mojave toxin in venom of Crotalus helleri (Southern Pacific Rattlesnake): molecular and geographic characterization. Toxicon, 44(7), 781-791.
Galán, J., Sánchez, E., Rodríguez-Acosta, A. & Pérez, J. (2004). Neutralization of venoms from two Southern Pacific Rattlesnakes (Crotalus helleri) with commercial antivenoms and endothermic animal sera. Toxicon, 43(7), 791-799.
Gómez, T. (2000). Estudio comparativo de la composición bioquímica del veneno en serpientes venenosas de Aguascalientes. México: Consejo Nacional de Ciencia y Tecnología.
Gregory-Dwyer, V., Egen, N., Bosisio, A., Righetti, P. & Russell, F. (1986). An isoelectric focusing study of seasonal variation in rattlesnake venom proteins. Toxicon, 24(10), 995-1000.
Habermann, E. & Hardt, K. (1972). A sensitive and specific plate test for the quantitation of phospholipase. Analytical Biochemistry, 50(1), 163-173.
Laemmli, U. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 277(5259), 680-685.
Lemos-Espinal, J. & Smith, H. (2007). Anfibios y reptiles del estado de Chihuahua, México. México: Conabio.
López-Lozano, J., Valle de Sousa, M., O. Ricart, C. A., Chávez-Olortegui, C., Flores Sánchez, E., G. Muñiz, E., Bühinheim, P. F. & Morhy, L. (2002). Ontogenetic variation of metalloproteinases and plasma coagulant activity in venoms of wild Bothrops atrox specimens from Amazonian rain forest. Toxican, 40(7), 997-1006.
Lowry, O., Rosebrough, N., Farr, A. & Randall, R. (1951). Protein measurement with the folin phenol reagent. Journal of Biological Chemistry, 193(1), 265-275.
Rael, E. D., Rivas, J., Chen, T., Maddux, N., Huizar, E. & Lieb, C. (1997). Diferences in Fibronolysis and Complement Inactivation by Venom Different Northern Blacktailed Reattlesnakes (Crotalus molossus molossus). Toxicon, 35(4), 505-513.
Sánchez, E., Solís, L., Ramírez, M. & Pérez, J. (2001). Partial characterization of a basic protein from Crotalus molossus molossus (northern blacktail rattlesnake) venom and production of a monoclonal antibody. Toxicon, 39(4), 523-537.