Resumen
La biología celular y molecular es un área de investigación de gran impacto y rápido crecimiento, la cual se ha convertido en un punto esencial para el desarrollo de nuevos agentes quimioterapéuticos con niveles bajos de toxicidad, particularmente para el cáncer. Aunque la era de la quimioterapia comenzó en los años 40, actualmente es necesario desarrollar nuevas terapias antitumorales que permitan tener un tratamiento apropiado para cada paciente y tipo de tumor, siendo necesaria la identificación de componentes celulares y moleculares involucrados en los procesos de carcinogénesis, para el desarrollo de agentes quimioterapéuticos que intervengan en la restauración o destrucción selectiva de las células cancerígenas. Actualmente, se ha demostrado que ciertos medicamentos, como los antibióticos (tetraciclinas, sulfonamidas y β-lactamas) y otros compuestos químicos (quinoxalinas) que son utilizados con otro fin terapéutico, han presentado efectos anticancerígenos, con una actividad antiproliferativa e inhibitoria, por lo cual pueden ser una nueva opción para el tratamiento farmacológico del cáncer.
Abstract
Cellular and molecular biology is a research field with high impact and fast growth; it becomes essential for the development of new chemotherapeutic agents with low toxicity, particularly against cancer. Although chemotherapy era began in the 40’s, it has been necessary to development new antitumoral therapies that produce appropriate treatment for each patient and kind of tumor. Therefore, identifying cellular and molecular components involved in the process of carcinogenesis for development of chemotherapeutic agents involved in restoration or selective destruction of cancer cells is necessary. Currently, it has been shown that certain drugs such as antibiotics (tetracycline, sulfonamide and β-lactams) and others chemicals compounds (quinoxalines) that are used for another purpose showed anticancer effects with antiproliferative and inhibitory activity. Therefore these could be a new option for pharmacological treatment of cancer.
Introducción
La célula es la unidad estructural y funcional de todo ser vivo, de la cual existen diferentes tipos; el cuerpo humano, por ejemplo, está compuesto por más de 200 tipos de células incomparables, cada una especializada para desarrollar funciones específicas. Las similitudes fundamentales de los diferentes tipos celulares proporcionan un marco común para estudiar los disímiles aspectos de la biología celular y molecular con distintas aplicaciones. El proceso más importante dentro de las células es su metabolismo, el cual se define como el conjunto de reacciones bioquímicas y procesos físico-químicos que ocurren dentro de ésta; estos procesos complejos están interrelacionados con la base de la vida a escala molecular, y permiten las diversas actividades celulares. El metabolismo se divide en dos procesos: catabolismo y anabolismo. Las reacciones catabólicas liberan energía, mientras que las anabólicas utilizan esta energía, por lo tanto, el catabolismo y el anabolismo son procesos acoplados que conforman el metabolismo, puesto que cada uno depende del otro. Además, una variedad de sistemas y procesos están implicados en el mantenimiento de la integridad celular. Sin embargo, las células no viven indefinidamente, y su vida media depende del tipo celular. Un daño irreversible puede hacer que se alcance un punto sin retorno, que impida a la célula realizar sus funciones vitales, conduciéndola a la muerte (Lizarbe-Iracheta, 2007).
Muerte celular (necrosis y apoptosis)
La muerte celular es un proceso dirigido por genes implicados en el desarrollo y la homeostasis de los organismos multicelulares, y ha constituido un paradigma, ya que investigaciones realizadas en los últimos años han revelado que la apoptosis no es la única vía de muerte celular programada implicada en la regulación de la homeostasis celular, la cual remueve las células indeseadas de los seres vivos. Desde hace más de tres décadas diversas investigaciones se han enfocado en estudiar los mecanismos de apoptosis y otros mecanismos de muerte celular, y sus posibles aplicaciones en enfermedades humanas, particularmente el cáncer y enfermedades neurodegenerativas (Zhivotovsky & Orrenius, 2010). Durante mucho tiempo, la necrosis ha sido considerada como una alternativa a la muerte celular programada a la apoptosis. La necrosis tiene características morfológicas distintas y se acompaña de una rápida permeabilización de la membrana plasmática. Sin embargo, datos recientes indican que la necrosis es causada por condiciones extremas y puede ser una respuesta fisiológica normal de eventos regulados (programados). El tipo de muerte celular por necrosis se produce cuando el daño del tejido es letal o se produce una muerte accidental, considerándose una muerte “patológica” de las células o tejidos del organismo. Se origina por una lesión aguda, irreversible, derivada de una situación no fisiológica o una condición patológica que no puede ser reparada por mecanismos de adaptación y resistencia; las células se hinchan, se deterioran sus estructuras y se paralizan funciones críticas para la vida. La apoptosis se lleva a cabo en respuesta a una variedad de estímulos y tensiones intra y extracelulares que normalmente implica el despliegue de una familia de cisteín-proteasas reguladoras dependientes de especificidad conservada. La apoptosis se caracteriza por una serie de eventos bioquímicos y morfológicos definidos que predisponen, preceden y acompañan a la muerte celular. Los efectos acumulativos de estos cambios fisiológicos están diseñados para detener el ciclo celular, reparar el ácido desoxirribonucleico (ADN) y detener la homeostasis; esta serie de eventos incluye la condensación de la cromatina, fragmentación del ADN frecuentemente utilizado como sello para definir apoptosis (Del Toro-Gonzalo, 2006; Proskuryakoy, Konoplyannikov & Gabai, 2003) y la exposición de la fosfatidilserina (PS) en la membrana externa. Se puede indicar que estos cambios previenen el daño a las células vecinas. La apoptosis también se acompaña de varios cambios morfológicos, como el balonamiento de la célula, reducción del volumen celular, condensación de la cromatina, fragmentación del núcleo y protrusiones de membrana plasmática denominados burbujeo (Dwyer, Camacho, Kohanski, Callura & Collins, 2012).
Adicionalmente, en el proceso de apoptosis, las familias de proteínas que tienen un papel importante son las caspasas, las cuales son las encargadas de ejecutar el proceso de muerte celular y activar a otras enzimas que degradan múltiples proteínas con el consiguiente desmantelamiento de la arquitectura celular. Se conocen aproximadamente 11 miembros de esta familia de proteínas que, a su vez, se dividen en dos subfamilias: la subfamilia de la caspasa 1, implicada en el control de la inflamación, y la subfamilia de la caspasa 3, especializada en desencadenar y ejecutar la muerte por apoptosis. Además, de manera intrínseca, las proteínas de la familia Bcl-2 regulan el proceso de apoptosis (los miembros de esta familia tienen actividad que median la muerte celular y están implicados en procesos de tumorigénesis y respuesta celular a la terapia antitumoral) (Lizarbe-Iracheta, 2007).
Efecto de agentes antitumorales
El cáncer es una enfermedad provocada por un grupo de células que se multiplican sin control. Este proceso es causado por anormalidades en el material genético de la célula. La malignidad del cáncer es variable según la agresividad de la multiplicación celular descontrolada. Se sabe que la quimioterapia es el mejor tratamiento anticancerígeno, sin embargo, la mayoría de los diferentes tipos de cáncer crean resistencia a la quimioterapia durante el tratamiento. El progreso de la biología celular y molecular está abriendo nuevos horizontes en la práctica médica, incluyendo el desarrollo de nuevos fármacos especialmente diseñados para interferir con el crecimiento de células cancerosas (Baytas, Inceler & Yilmaz, 2013), por lo cual es de suma importancia conocer el efecto a nivel celular y molecular que ocasionan los agentes antitumorales en desarrollo.
En la búsqueda de nuevas opciones terapéuticas para el tratamiento del cáncer se han estudiado diversos compuestos de distinta naturaleza química como una opción viable, dentro de los cuales se han encontrado efectos anticancerígenos muy prometedores en algunos antibióticos, como las tetraciclinas, sulfonamidas y las β-lactamas (Wang et al., 2012), aunque también se han descrito algunos otros compuestos con propiedades anticancerígenas, tales como las quinoxalinas (Rajule, Bryant, López, Luo & Natarajan, 2012). Por ello, a continuación daremos una breve, pero relevante, información del efecto a nivel celular y molecular que ocasionan algunos de estos potenciales agentes antitumorales.
Tetraciclinas
Las tetraciclinas son conocidas como antibióticos de amplio espectro, sin embargo, se le han atribuido acciones biológicas terapéuticas en otras enfermedades, ya que juegan un papel importante en la invasión celular, por lo que se relacionan con la agresividad tumoral y el potencial metastásico de algunas neoplasias; un ejemplo de ello es el antibiótico denominado minociclina (figura 1), conocido por ser un agente anti-apoptótico potente, su mecanismo de acción, se sugiere, está relacionado con efectos específicos ejercidos sobre las vías de señalización de apoptosis. De manera general, las tetraciclinas muestran en su estructura química regiones electro-densas que las lleva a estar implicadas en procesos oxidativos responsables en muchos casos de daño celular. Una de las capacidades más estudiadas de las tetraciclinas es su potente capacidad para inhibir las metaloproteasas de matriz (MMPs), que son una familia de endopeptidasas dependientes de zinc y calcio encargadas del remodelado y degradación de la matriz extracelular y la membrana basal, permitiendo en el caso de cáncer que las células invadan tejido conectivo y vasos sanguíneos, facilitando la liberación de factores que favorecen el crecimiento tumoral. Por lo tanto, las tetraciclinas, además de inhibir estas metaloproteasas, también impiden su producción, ya que interfieren en la activación proteolítica de pro-MMP, mediante la quelación de zinc en la zona de unión con la enzima, bloqueando la actividad de MMPs. Particularmente, se ha demostrado que la doxiciclina (figura 1) es más efectiva que la minociclina en la inhibición de MMPs (García-Álvarez & Oteo, 2010; Griffin, Fricovsky, Ceballos & Villarreal, 2010).
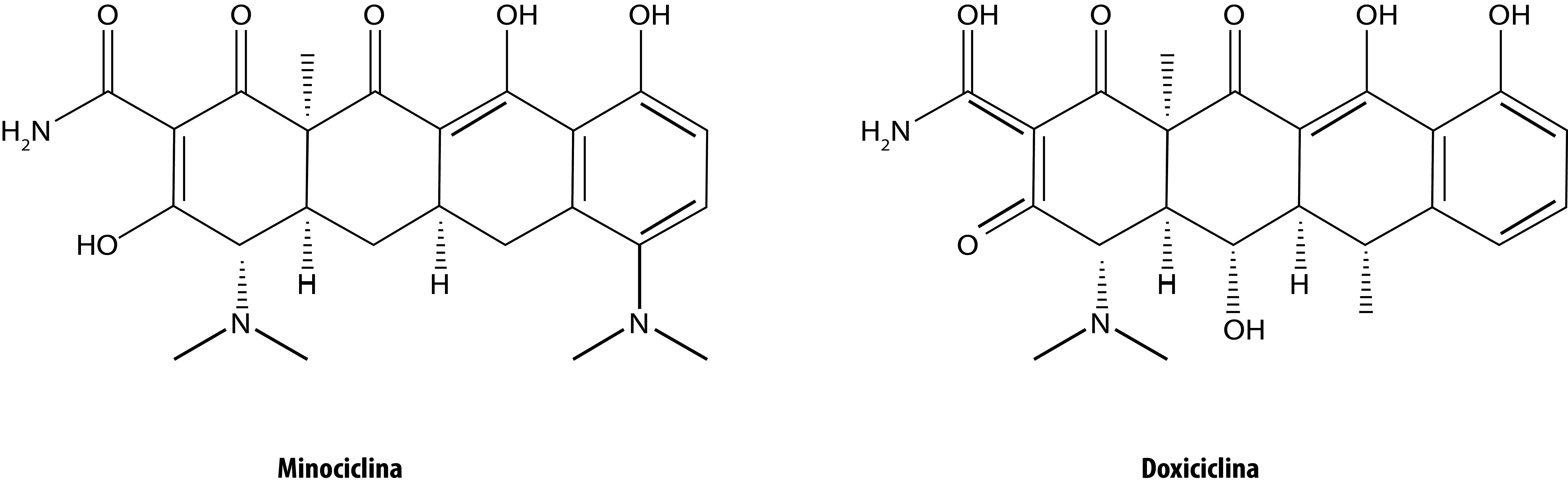
Figura 1. Estructura de dos fármacos derivados de tetraciclinas con actividad anticancerígena.
Fuente:
Minociclina (2014);
Doxiciclina (2014).
CloseSulfonamidas
Actualmente, de manera interesante se ha informado que las sulfonamidas, además de tener una actividad antibacterial, poseen actividad antitumoral sustancial, ya que actúan como inhibidores de la anhidrasa carbónica (AC), una enzima que tiene un papel importante en el proceso de regulación del pH celular, de la cual se presentan 16 isoformas, siendo algunas de ellas sobre-expresadas en ciertos tipo de tumores. Un estudio indica que la combinación de inhibidores de AC con selenio parece tener un efecto protector en las diversas etapas de cáncer. La combinación de sulfonamidas con el selenio es un nuevo enfoque en la terapia anticancerígena, debido a que el selenio es un componente esencial para la dieta de los animales, incluidos los seres humanos, el cual presenta una potencial eficacia como compuesto quimiopreventivo contra el cáncer. Las proteínas intracelulares de selenio son en sí mismas un componente importante del constituyente esencial del complejo selenio-cisteína. Los mecanismos de acción de la combinación de los inhibidores de AC con selenio contra el cáncer no se han entendido completamente, sin embargo, varios de los siguientes mecanismos de acción han sido propuestos contra el cáncer: protección antioxidante, respuesta inmunitaria mejorada, modulación de la proliferación celular (ciclo celular y apoptosis), inhibición de la invasión de células tumorales e inhibición de la angiogénesis (Gupta et al., 2013).
Interesantemente, se ha estudiado una serie de compuestos derivados de arilsulfonil mono-índoles, bis-índoles y tris-índoles que se han sintetizado y evaluado para determinar su citotoxicidad sobre líneas cancerosas humanas: carcinoma colangiocelular (HuCCA-1), carcinoma hepatocelular (HEpG2), carcinoma de pulmón (A-549) y leucemia linfoblástica (MOLT-3). Los resultados muestran una actividad anti-proliferativa significativa de los compuestos con estructura de bis- y tris- con un núcleo de indol dotados de un grupo fenólico o con un grupo funcional que puede formar enlaces de hidrógeno junto con el sustituyente hidrófobo en el resto de la benceno sulfonamida (Pingaew, Prachayasittikul, Ruchirawat & Prachayasittikul, 2013), lo que valida el potencial uso de derivados de sulfonamidas en el desarrollo de fármacos anticancerígenos.
En estudios preclínicos destaca en el grupo de las sulfonamidas el compuesto sintético de arilsulfonamida denominado KCN1 (figura 2), al cual le evaluaron la actividad sobre la proliferación celular y la disrupción del ciclo celular de células de cáncer pancreáticas. Los resultados muestran que el compuesto KCN1 de una manera dependiente de la dosis inhibe el crecimiento celular e induce la detención del ciclo celular, mismo que se logra a través de la modulación de las quinasas dependientes de ciclina, que son una familia de proteínas que regulan el correcto desarrollo del ciclo celular en eucariotas. Por lo anterior se ha demostrado que el compuesto KCN1 puede ejercer una potente citotoxicidad y efectos de inhibición de proliferación celular hacia células cancerígenas, dando lugar a una baja regulación de importantes proteínas oncogénicas (Wang et al., 2012).
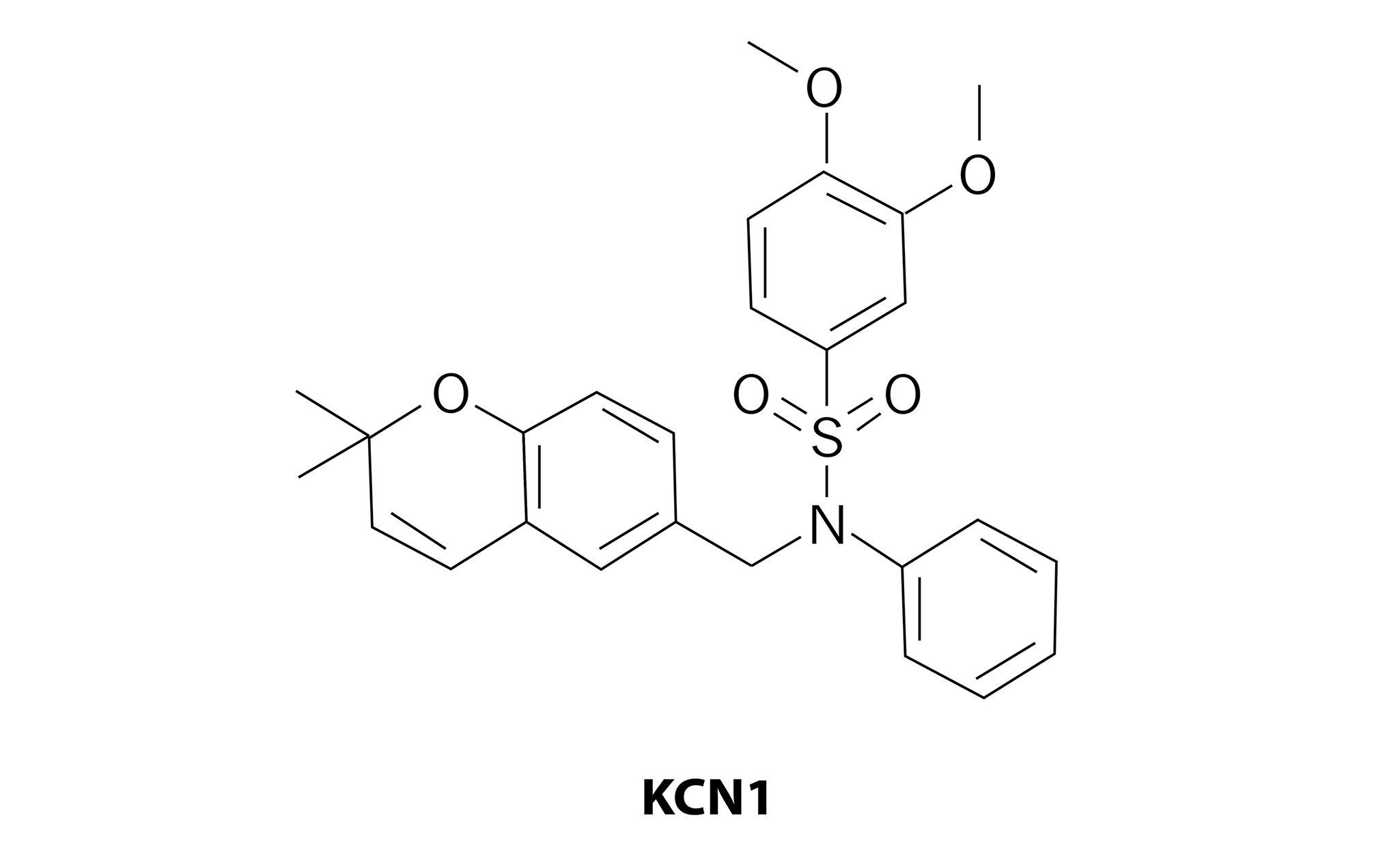
Figura 2. Compuesto derivado de sulfonamida con actividad anticancerígena.
Fuente:
Wang et al. 2012. Closeβ-lactamas
Recientemente, con el objetivo de desarrollar nuevos agentes quimioterapéuticos, se han evaluado varios compuestos derivados de β-lactamas. Muchos de los medicamentos contra el cáncer en uso actual son tóxicos, sin embargo, los antibióticos lactámicos se han utilizado durante muchos años para tratar las infecciones bacterianas con baja o nula toxicidad. Debido a la facilidad de la síntesis y manipulación estructural se cree que los compuestos lactámicos pueden tener potencial de ser convertidos en agentes contra el cáncer. Recientes estudios indican que una familia de antibióticos lactámicos presenta propiedades que inducen apoptosis contra algunos tipos de cáncer; un ejemplo es el compuesto denominado β-lactama 1 (figura 3), capaz de inducir activación de la caspasa 3 y, por lo tanto, apoptosis; inhibe la replicación de ADN asociado con la inducción de daño del ADN. Los mecanismos de acción aún no están completamente entendidos, pero se sabe que tienen relación con el grupo N-metiltiol y el número de átomos de carbono, el número de átomos de carbono en el grupo N-metiltiol es inversamente proporcional a la capacidad inductora de apoptosis, y la sustitución de N-metiltiol por N-benciltiol mostró que disminuye la actividad de inducción de apoptosis (Smith et al., 2002).
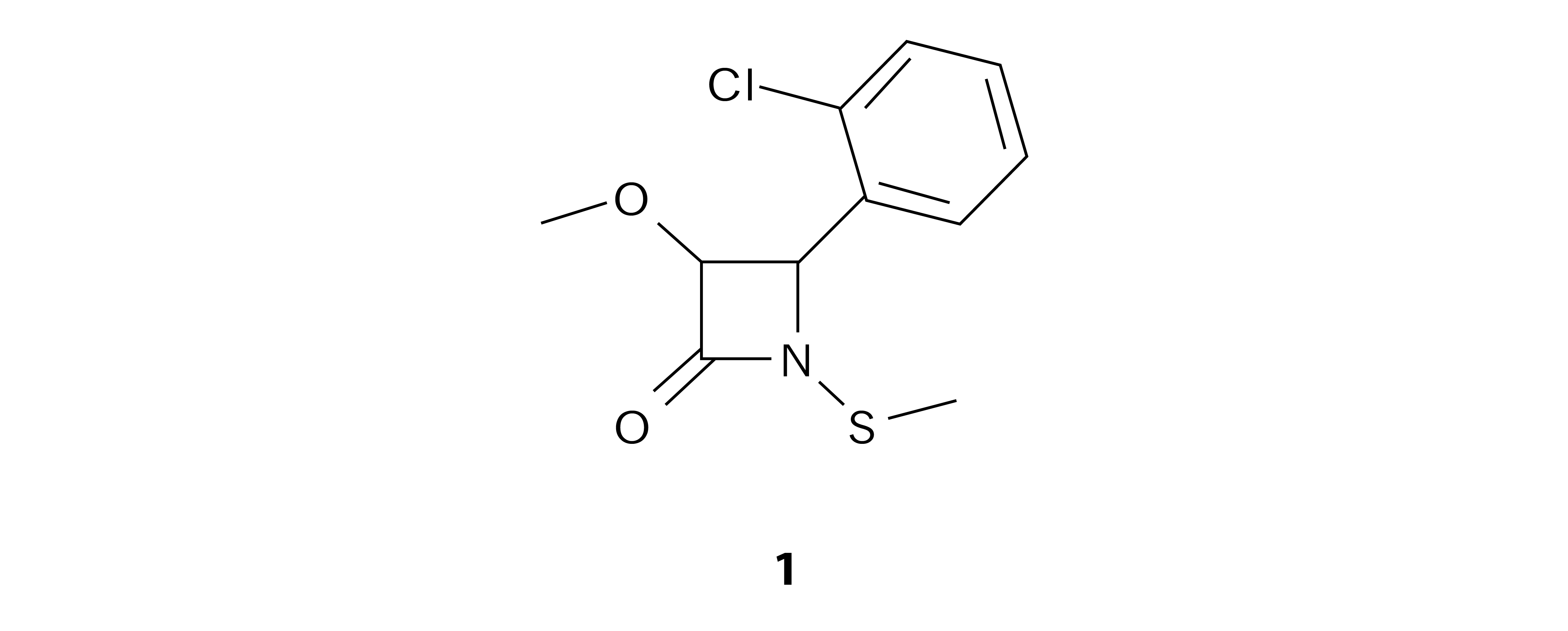
Figura 3. Compuesto derivado de b-lactama con actividad anticancerígena.
Fuente:
Smith et al. 2002. CloseQuinoxalinas
Una quinoxalina es un compuesto heterocíclico, formado por un anillo de benceno y uno de pirazina, por lo que también son llamadas benzopirazinas; se emplean en el área farmacéutica para la elaboración de diferentes medicamentos. Varios análogos de quinoxalina están en desarrollo preclínico y clínico contra una variedad de enfermedades, interesantemente resaltan las propiedades anticancerígenas (Rajule, et al., 2012).
Dentro de los compuestos estudiados están los derivados de quinoxalina 2,3,6-trisubstituidas, a los cuales se les evaluó su acción anticancerígena en líneas celulares de cáncer de pulmón. Los resultados mostraron que estos compuestos impiden la proliferación de células a través de la inhibición de la vía de señalización de Wnt-β-catenina, la cual es de gran importancia en la proliferación, migración y división celular (Lee, Park, Dong & Gong, 2010; Lee, Gong, Park & Dong, 2013). Otros compuestos derivados de quinoxalina estudiados ampliamente son los derivados de piperazinilquinoxalinas. De entre ellos, el compuesto 2 (IC50= 24 nM) (figura 4)presenta una acción inhibitoria de la fosfatidilinositol-3-kinasa (P13K) como tratamiento para el cáncer; esta vía de señalización es crucial en aspectos celulares relacionados con el crecimiento y la supervivencia de la célula, e induce apoptosis celular (Wu et al., 2012). Adicionalmente en otro estudio, se evaluaron chalconas derivadas de quinoxalina, que actúan a nivel de la vía P13K; estos compuestos (3, 4, 5 y 6) (figura 4) mostraron eficacia anticancerígena en las líneas celulares de glioma U-138 y C6 en un modelo in vitro, sin embargo, se recomendó llevar a cabo estudios in vivopara confirmar esta eficacia, por lo que estos derivados pueden representan una alternativa útil para el tratamiento del cáncer (Mielcke et al., 2012).
Por otra parte, derivados de 3-aril-quinoxalinas-2-carbonitrilo fueron evaluados en las líneas celulares SMMC-7721, K562, KB, A549 y PC-3, mostrando actividad citotóxica e hipoxia, induciendo apoptosis en una vía dependiente de caspasas (Hu, Xia, Shangguan, Liu, Hu & Sheng, 2012).Otro compuesto derivado de la familia de imidazoquinoxalinas de importancia es el denominado EAPB0203 (figura 4), el cual inhibe el crecimiento en los linfomas de células T sin la respuesta pro-inflamatoria asociada a otros miembros de esta familia, mostrando inhibición de la proliferación celular, detención del ciclo celular en fase G2/M e inducción de apoptosis dependiente de caspasa y liberación de citocromo c (Moarbess et al., 2008).
De modo adicional, el compuesto R(+)XK469 (figura 4) es un ejemplo de un análogo de quinoxalina en fase clínica para el tratamiento de pacientes con tumores sólidos refractarios avanzados (Kakodkar et al., 2011). Esto ha dado lugar a la síntesis de bibliotecas enfocadas a análogos de quinoxalina para explorar aún más la relación estructura-actividad (Rajule et al., 2012). Sin embargo, a pesar de la actividad de las quinoxalinas, también se ha reportado que este tipo de compuesto derivados de aminas aromáticas heterocíclicas (HAAS) se encuentran en alimentos (carnes y pescados) que han sido sometidos a altas temperaturas de cocción, los cuales ejercen actividad genotóxica después de la transformación metabólica por enzimas. Se ha examinado la respuesta celular y genómica de cierto tipo de células después de la exposición a estas HAAS, lo cual reveló el aumento de roturas de la cadena de ADN y detención del ciclo celular. La elevada expresión de Bcl-2 y la baja regulación de Bax indica que las HAAS podrían suprimir la supervivencia celular y mutar a las células, por lo que se considera de manera contraria a lo que se informó que ciertos derivados de quinoxalinas podrían tener una actividad cancerígena (Pezdirc, Zegura & Filipic, 2013).
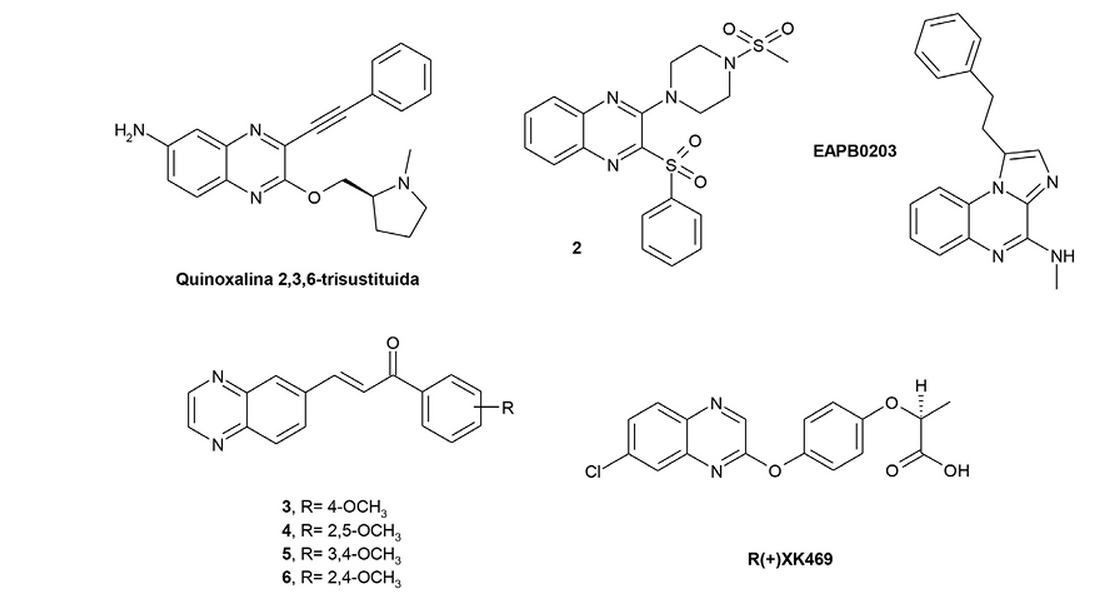
Figura 4. Compuestos derivados de quinoxalina con actividad anticancerígena.
Fuente:
Wu et al. 2012;
Mielcke et al. 2012;
Hu et al. 2012;
Moarbess et al. 2008;
Kakodakar et al. 2011. Close
CONCLUSIONES
El estudio de los mecanismos a nivel celular y molecular que afectan el proceso de muerte celular en diversas enfermedades es de suma importancia, ya que permite un mejor conocimiento de las posibles vías que pueden ser una alternativa para el desarrollo de nuevas opciones terapéuticas. De manera interesante se ha establecido que diversos compuestos con actividad anticancerígena, como las tetraciclinas, sulfonamidas, b-lactamas y quinoxalinas, tienen un mecanismo de acción a través de la inhibición o interrupción de las vías de señalización de la muerte celular, lo cual puede llevar al desarrollo de compuestos más selectivos para el tratamiento del cáncer y otras enfermedades.
REFERENCIAS
Baytas, S. N., Inceler, N. & Yilmaz, K. J. A. (2013). Synthesis, cytotoxicity, and molecular properties prediction of novel 1,3-diarylpyrazole derivatives.Medicinal Chemistry Research, 22, 4893-4908.
Del Toro-Gonzalo (octubre, 2006). Muerte celular programada. Revisión del paradigma de apoptosis-necrosis y formas alternativas de muerte celular. Trabajo presentado en el VIII Congreso Virtual Hispanoamericano, Alcorcón, España.
Doxiciclina (2014). Recuperado el 25 de Junio del 2014 de http://es.wikipedia.org/ wiki/Doxiciclina
Dwyer, D. J., Camacho, D. M., Kohanski, M. A., Callura, J. M. & Collins, J. J. (2012). Antibiotic-induced bacterial cell death exhibits physiological and biochemical hallmarks of apoptosis. Molecular Cell, 46(5), 561-572.
García-Álvarez, L. & Oteo, J. A. (2010). Efectos no antimicrobianos de las tetraciclinas. Revista Española de Quimioterapia, 23(1), 4-11.
Griffin, M. O., Fricovsky, E., Ceballos, G. & Villarreal, F. (2010). Tetracyclines: a pleitropic family of compounds with promising therapeutic properties.American Journal of Physiology: Cell Physiology, 299(3), C539-548.
Gupta, R., Kazmi, I., Afzal, M., Khan, R., Chauhan, M., Al-Abbasi, F. A., Ahmad, A. & Anwar, F. (2013). Combination of sulfamethoxazole and selenium in anticancer therapy: a novel approach. Molecular and Cellular Biochemistry, 384(1-2), 279-285.
Hu, Y., Xia, Q., Shangguan, S., Liu, X., Hu, Y. & Sheng, R. (2012). Synthesis and biological evaluation of 3-aryl-quinoxaline-2-carbonitrile 1,4-di-N-oxide derivatives as hypoxic selective anti-tumor agents. Molecules, 17(8), 9683-9696.
Kakodkar, N. C., Peddinti, R., Kletzel, M., Tian, Y., Guerrero, L. J., Undevia, S. D., Geary, D., Chlenski, A., Yang, Q., Salwen, H. R. & Cohn, S. L. (2011). The quinoxaline anti-tumor agent (R+)XK469 inhibits neuroblastoma tumor growth. Pediatric Blood Cancer, 56(1), 164-167.
Lee, S. B., Park, Y, I., Dong, M. S. & Gong, Y. D. (2010). Identification of 2,3,6-trisubstituted quinoxaline derivatives as a Wnt2/b-catenin pathway inhibitor in non-small lung cancer cell lines.Bioorganic and Medicinal Chemistry Letters, 20(19), 5900-5904.
Lee, S. B., Gong, Y. D., Park, Y. I. & Dong, M. S. (2013). 2,3,6-Trisubstituted quinoxaline derivative, a small molecule inhibitor of the Wnt/beta-catenin signaling pathway, suppresses cell proliferation and enhances radiosensitivity in A549/Wnt2 cells.Biochemical and Biophysical Research Communications, 431(4), 746-752.
Lizarbe-Iracheta, M. A. (2007). El suicidio y la muerte celular.Real Academia de Ciencias Exactas-España, 101(2), 1-33.
Mielcke, T. R., Mascarello, A., Filippi-Chiela, E., Zanin, R. F., Lenz, G., Leal P., Chiaradia, L. D., Yunes R. A., Nunes, R. J., Battastini, A. M., Morrone, F. B. & Campos, M. M. (2012). Activity of novel quinoxaline-derived chalcones on in vitro glioma cell proliferation. European Journal of Medicinal Chemistry, 48, 255-264.
Moarbess, G., El-Hajj, H., Kfoury, Y., El-Sabban, M. E., Lepelletier, Y., Hermine, O., Deleuze-Masquéfa, C., Bonnet, P. A. & Bazarbachi, A. (2008). EAPB0203, a member of the imidazoquinoxaline family, inhibits growth and induces caspasa-dependent apoptosis in T-cell lymphomas and HTLV-I-associated adult T-cell Leukemia/lymphoma.Blood, 111(7), 3770-3777.
Minociclina (2014). Recuperado el 25 de Junio del 2014 de http://es.wikipedia. org/wiki/Minociclina
Pezdirc, M., Zegura B. & Filipic, M. (2013). Genotoxicity and induction of DNA damage responsive genes by food-borne heterocyclic aromatic amines in human hepatoma HepG2 cells. Food and Chemical Toxicology, 59, 386-394.
Pingaew, R., Prachayasittikul, S., Ruchirawat, S. & Prachayasittikul, V. (2013). Synthesis and structure-activity relationship of mono-indole-, bis-indole, and tris-indole-based sulfonamides as potential anticancer agents. Molecular Diversity, 17(3), 595-604.
Proskuryakov, S. Y., Konoplyannikov, A. G. & Gabai, V. L. (2003). Necrosis: a specific form of programmed cell death?Experimental Cell Research, 283(1), 1-16.
Rajule, R., Bryant, V. C., López, H., Luo, X. & Natarajan, A. (2012). Perturbing pro-survival proteins using quinoxaline derivatives: A structure activity relationship study. Bioorganic and Medicinal Chemistry, 20(7), 2227-2234.
Smith, D. M., Kazi, A., Smith, L., Long, T. E., Heldreth, B., Turos, E. & Dou, Q. P. (2002). A novel b-Lactam antibiotic activates tumor cell apoptotic program by inducing DNA damage. Molecular Pharmacology, 61(6), 1348-1358.
Wang, W., Ao, L., Rayburn, E. R., Xu, H., Zhang, X., Zhang, X., Nag, S. A., Wu, X., Wang, M. H., Wang, H., Van Meir, E. G. & Zhang, R. (2012). KCN1, a novel synthetic sulfonamide anticancer agent: in vitro and in vivo anti-pancreatic cancer activities and preclinical pharmacology. Public Library of Science One, 7(9), e44883.
Wu, P., Su, Y., Guan, X., Liu, X., Zhang, J., Dong, X., Huang, W. & Hu, Y. (2012). Identification of novel piperazinylquinoxaline derivatives as potent phosphoinositide 3-kinase (PI3K) inhibitors.Public Library of Science One, 7(8), e43171.
Zhivotovsky, B. & Orrenius, S. (2010). Cell death mechanisms: Cross-Talk and role in disease. Experimental Cell Research, 316(8), 1374-1383.