RESUMEN
La diabetes es una enfermedad metabólica caracterizada por hiperglucemia y resistencia a la insulina. La curcumina es un potencial agente antidiabético que regula la expresión génica y diferentes vías de señalización. Se pretende determinar el efecto de la curcumina sobre la expresión de Proteína Cinasa Activada por AMP (AMPK), Proliferador Peroxisomal gamma (PPARγ), Factor Nuclear Kappa de los linfocitos B (NF-κB) y Sirtuina 1 (SIRT1) en hígado de ratón diabético. Se utilizaron cuatro grupos de ratones (n = 3): silvestres (WT), diabéticos (db/db) y WT y db/db tratados con 0.75% de curcumina en el alimento (WT+C y db/db+C, respectivamente) por ocho semanas. La expresión de las proteínas se determinó por Western blot. Como resultados la curcumina previno parcialmente la pérdida de peso en los ratones db/db, incrementó la expresión de AMPK y PPARγ y disminuyó la expresión de NF-κB en los ratones diabéticos, pero no modificó la expresión de SIRT1. Se concluyó que la curcumina regula la expresión de AMPK, PPARγ y NF-κB, pero no de SIRT1.
ABSTRACT
Diabetes is a metabolic disease characterized by hyperglycemia and insulin resistance. Curcumin is a potential antidiabetic agent regulates gene expression and different signaling pathways. The present study determined the effect of curcumin on AMPK, PPARγ, SIRT1 and NF-κB expression in liver of a diabetic mice. Four groups of mice (n = 3) were used: wild type (WT), diabetics (db/db) and WT and db/db treated with Curcumin 0.75% (WT+C and db/db+C, respectively) administered in the diet for 8 weeks. Protein expression was determined by Western blot. Curcumin prevented partially the weight loss in db/db mice, increased AMPK and PPARγ expression and diminished NF-κB protein in db/db mice, but did not alter the SIRT1 expression. Curcumin regulates AMPK, PPARγ and NF-κB expression, but not of SIRT1.
INTRODUCCIÓN
México ocupa el segundo lugar mundial de mayor prevalencia de obesidad con 22 millones de personas adultas (30% de la población) (Barrera-Cruz, Rodríguez-González & Molina-Ayala, 2013). La obesidad es un factor clave para el desarrollo de la diabetes mellitus tipo 2 (DM2) (Xu et al., 2003), la cual se caracteriza por resistencia a la insulina y la presencia de hiperglucemia. La hiperglucemia crónica conlleva complicaciones en diferentes órganos, entre ellos el hígado, donde se altera la homeostasis de la glucosa, la gluconeogénesis y la oxidación de ácidos grasos (Al-Mukhtar, Fadhil & Hanna, 2012).
La obesidad y la DM2 están asociadas con inflamación crónica de bajo grado, debido, en parte, a la activación del factor nuclear kappa de los linfocitos B (NF-κB). A su vez, NF-κB desregula la actividad de otras vías de señalización metabólicas donde participa la Sirtuina 1 (SIRT1) y la proteína cinasa activada por AMP (AMPK), proteínas reguladoras de ciertas rutas intracelulares como la captación de glucosa en el músculo esquelético y la oxidación hepática de los ácidos grasos (Oakhill, Scott & Kemp, 2012). Se ha sugerido que la SIRT1 participa en la regulación de la sensibilidad a la insulina, en parte, a través de su activación por AMPK (Hou et al., 2008; Lan, Cacicedo, Ruderman & Ido, 2008).
En el hígado, la SIRT1 participa en el control de la homeostasis de la glucosa, a través de la desacetilación del proliferador peroxisomal gamma (PPARγ) y su co-regulador metabólico PGC-1a, incrementando así la producción de glucosa hepática y el uso de los ácidos grasos para la obtención de energía (Picard & Auwerx, 2002; Picard et al., 2004; Rodgers et al., 2005).
A pesar de que es posible el control de la glucosa mediante ejercicio y dieta y que existen fármacos para el tratamiento de la DM2, esta enfermedad y sus complicaciones siguen siendo un problema grave de salud en todo el mundo. Por ello, es deseable el uso de tratamientos alternativos de bajo costo y con menos efectos secundarios para los pacientes. La curcumina, un componente activo de la Curcuma longa, ha sido utilizada durante siglos por habitantes de la India, principalmente como un condimento. Sin embargo, se han descrito varias propiedades farmacológicas debido a que tiene efectos antioxidantes, anti-inflamatorios e hipoglucemiantes (Gupta, Patchva, Koh & Aggarwal, 2012). Diversos estudios en modelos animales y en humanos han reportado sus múltiples beneficios al organismo (Franco-Robles et al., 2013; Martínez-Morúa et al., 2013; Zhang, Fu, Gao & Liu, 2013), pero el mecanismo no está completamente claro. Se ha sugerido que la curcumina tiene actividad anti-inflamatoria a través de la modulación de una ruta de señalización inflamatoria u oxidativa que incluye al NF-κB, el factor relacionado con el factor nuclear E2 (Nrf2) y/o las rutas de señalización dependientes de AMPK (Alappat & Awad, 2010). Como la curcumina regula múltiples blancos moleculares a través de la inducción o inhibición de la expresión génica, las vías de señalización o mediante interacción directa (Shehzad & Lee, 2013), en este trabajo se estudió el efecto de la curcumina sobre la expresión de AMPK, SIRT1, PPARγ y NF-κB en el hígado de ratones diabéticos obesos db/db.
MATERIALES Y MÉTODOS
Modelo animal y tratamiento con curcumina
Los ratones fueron mantenidos en el bioterio de la División de Ciencias de la Salud de la Universidad de Guanajuato, siguiendo los lineamientos de ética de la norma (NOM-062-ZOO-1999). Los ratones tuvieron acceso a agua potable estéril y alimento adquirido de Harlan, México (23% proteína, 17% grasa y 60% hidratos de carbono), ad libitum.
Se utilizaron cuatro grupos de ratones (n = 3): silvestres (WT), diabéticos (db/db) y WT y db/db tratados con 0.75% de curcumina en el alimento (WT+C y db/db+C, respectivamente) por ocho semanas. La suplementación con curcumina (Curcuminoids, Advanced nutrition, Gdl, Jal., México) representa una dosis de 20 mg/ratón/día, considerando un consumo de alimento de 2.7 g/ratón/día-2.8 g/ratón/día.
Determinación de peso corporal y glucosa sanguínea
Al inicio y al final del tratamiento los ratones fueron pesados en una balanza granataria (Scout Ohaus, Florham Park N. J.) y al momento del sacrificio se midió la concentración de glucosa en sangre con un kit comercial (Accutrend, GCT, Roche) de acuerdo con las instrucciones del fabricante.
Extracción de proteína total
Los ratones se sacrificaron por decapitación y se obtuvo el hígado, usando un buffer de lavado (20 mM Tris/HCl, 10 mM EDTA, 2 mM DTT, pH 7.8). Las proteínas del hígado se obtuvieron mediante extracción fenólica y centrifugación diferencial como se reportó previamente (Hurkman & Tanaka, 1986). Brevemente, el hígado se homogenizó en 3 mL de buffer de extracción de proteínas (sacarosa 0.7 M, tris 0.5 M, KCl 30 mM, EDTA 50 mM, 2-βmercaptoetanol 2%, PVPP 12 mg/mL, a 4 ºC), más un inhibidor de proteasas y 3 mL de fenol saturado en agua. Se recuperó la fase fenólica y se precipitó en cinco volúmenes de acetato de amonio 0.1 M en metanol frío (-20 °C, toda la noche). La proteína se disolvió en 300 μl de buffer de Laemli 2X (Tris-HCl 0.125M, SDS 4%, Glicerol 20%, mercaptoetanol 10%, pH 6.8). La concentración de proteína se determinó con un kit comercial (2-D Quant kit, GE Healthcare Biosciences). Se midió la concentración de proteína en un espectrofotómetro Multiskan® a una longitud de onda de 750 nm.
Electroforesis y Western blot
Se cargaron 40 µg de proteína en buffer de Laemli para obtener un volumen final de 15 µL. Se usaron geles prefabricados de poliacrilamida al 2%, y la electroforesis se realizó en un sistema Mini-PROTEAN Tetra Cell, 200V, 40 min. Para el Western blot se usaron membranas de nitrocelulosa y el sistema Mini Trans-Blot, 90 V, 1.2 h. Las membranas fueron incubadas por 3 h a temperatura ambiente en un buffer de bloqueo (25 mmol/L Tris (pH 7.6), 154 mmol/L NaCl, 0.1% Tween-20 y 2% leche light en polvo). Los anticuerpos primarios (Santa Cruz Biotechnology) se incubaron durante toda la noche a 4 ºC. Los anticuerpos secundarios conjugados a la peroxidasa HRP (Santa Cruz Biotechnology) se incubaron durante 1.5 h en agitación constante. La quimiodetección se realizó en un fotodocumentador XRS+ System (Bio-Rad, CA). Los resultados se reportan como la relación proteína/$\alpha $-tubulina.
Análisis estadístico
Se utilizó una prueba de Kruskal Wallis y una prueba a post hoc de Tukey SD para encontrar diferencias entre los grupos. Los datos se reportan como media ± Error Estándar (EE); para el análisis se usó el software ESTATISTICA10. Se consideró una diferencia significativa cuando p ≤ 0.05.
RESULTADOS
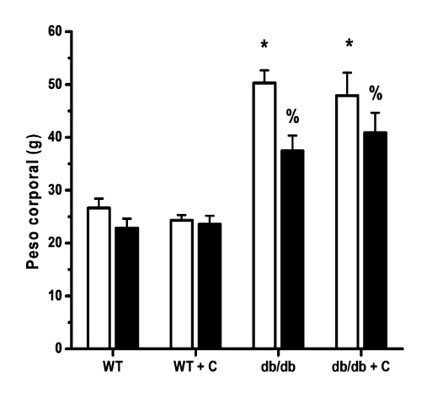
En la figura 1 se observa que el peso inicial de los ratones fue similar en los grupos WT y WT+C (24.2 g ± 0.8 g y 25.2 g ± 0.6 g, respectivamente) y entre los db/db y db/db+C (46.9 g ± 4.9 g y 47.9 g ± 4.3 g, respectivamente). El peso final de los ratones db/db y db/db+C (34.6 g ± 7.0 g y 40.8 g ± 6.5 g, respectivamente) también fue mayor que el de los ratones WT y WT+C (22.8 g ± 2.5 g y 23.6 g ± 3.9 g, respectivamente). Los ratones diabéticos pesaron más que los ratones sanos al inicio y al final del tratamiento. En el periodo de tratamiento los ratones db/db perdieron 12.5 g ± 3.0 g de peso, mientras que los ratones del grupo db/db+C perdieron 7.0 g ± 1.3 g. Esta diferencia en la pérdida de peso corporal de los ratones no fue significativa estadísticamente.
|
| |
 |
| |
Figura 1. Efecto de la curcumina sobre el peso corporal de los ratones.
WT, ratones control, WT+C, ratones control tratados con curcumina. db/db, ratones diabéticos. db/db+C, ratones diabéticos tratados con curcumina □, peso inicial ■, peso final. Los resultados se muestran como la media ± EE. * vs WT y WT+C, p < 0.001; % vs. WT y WT+C, p < 0.01.
Fuente: Elaboración propia. |
 |
Figura 1. Efecto de la curcumina sobre el peso corporal de los ratones.
WT, ratones control, WT+C, ratones control tratados con curcumina. db/db, ratones diabéticos. db/db+C, ratones diabéticos tratados con curcumina □, peso inicial ■, peso final. Los resultados se muestran como la media ± EE. * vs WT y WT+C, p < 0.001; % vs. WT y WT+C, p < 0.01.
Fuente: Elaboración propia. Close |
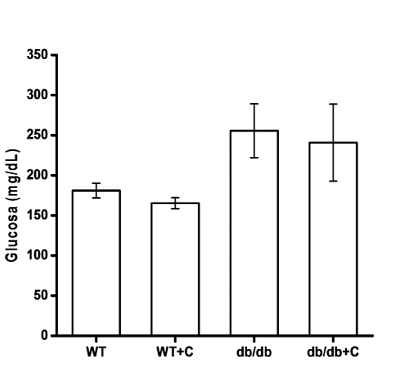
Los ratones diabéticos db/db y db/db+C presentaron mayor concentración de glucosa sanguínea (255.43 mg/dL ± 33.60 mg/dL y 240.66 mg/dL ± 48.11 mg/dL, respectivamente) que los ratones control WT y WT+C (181 mg/dL ± 9.11 mg/dL y 165.25 mg/dL ± 6.97 mg/dL, respectivamente), aunque la diferencia estadística no fue significativa (p = 0.07) y la curcumina no tuvo efecto (figura 2).
|
| |
 |
| |
Figura 2. Efecto de la curcumina sobre la concentración de glucosa sanguínea de los ratones. Al final de las ocho semanas de tratamiento se midió la concentración de glucosa sanguínea en los ratones. Los resultados se muestran como la media ±EE.
Fuente: Elaboración propia. |
 |
Figura 2. Efecto de la curcumina sobre la concentración de glucosa sanguínea de los ratones. Al final de las ocho semanas de tratamiento se midió la concentración de glucosa sanguínea en los ratones. Los resultados se muestran como la media ±EE.
Fuente: Elaboración propia. Close |
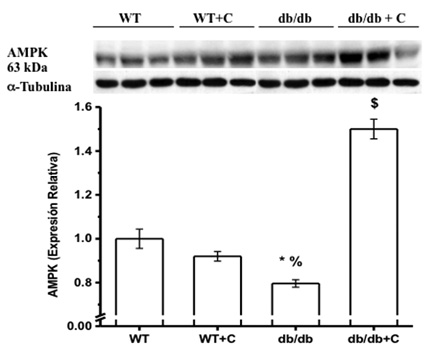
la figura 3 muestra que la proporción de expresión de AMPK/Tubulina es menor en los ratones db/db (0.796 ± 0.017) comparada con los grupos WT y WT+C (1.0 ± 0.044 y 0.92 ± 0.022, respectivamente). La curcumina incrementó la proporción AMPK/Tubulina en el grupo db/db+C (1.5 AMPK/Tubulina ± 0.045 AMPK/Tubulina), sugiriendo así un efecto benéfico, incrementando la expresión de AMPK hasta un nivel mayor que el de los ratones sanos.
|
| |
 |
| |
Figura 3. Efecto de la curcumina sobre el peso corporal de los ratones *vs WT, p < 0.005; %vs. WT+C, p < 0.05; $vs. WT, WT+C y db/db+C, p < 0.001. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. |
 |
Figura 3. Efecto de la curcumina sobre el peso corporal de los ratones *vs WT, p < 0.005; %vs. WT+C, p < 0.05; $vs. WT, WT+C y db/db+C, p < 0.001. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. Close |
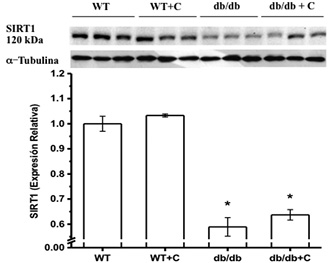
La proporción de expresión de SIRT1/Tubulina se encontró disminuida en los grupos de ratones db/db y db/db+C (0.589 ± 0.037 y 0.637 ± 0.021, respectivamente) con respecto a los grupos de ratones sanos WT y WT+C (1.0 ± 0.03 y 1.033 ± 0.006, respectivamente). La curcumina no modificó la expresión de SIRT1 en ambos grupos de ratones (figura 4).
|
| |
 |
| |
Figura 4. Efecto de la curcumina sobre el peso corporal de los ratones. *vs. WT y WT+C, p < 0.001. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. |
 |
Figura 4. Efecto de la curcumina sobre el peso corporal de los ratones. *vs. WT y WT+C, p < 0.001. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. Close |
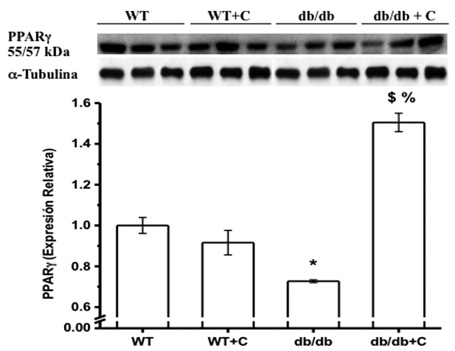
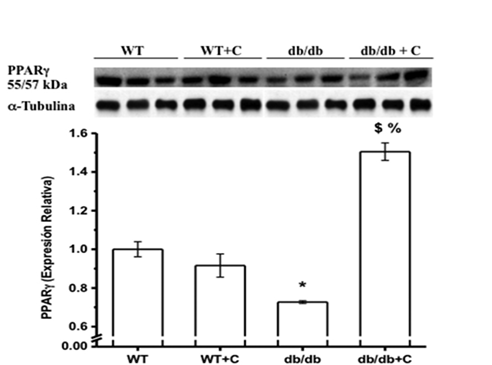
La figura 5 muestra que la proporción de expresión de PPARγ/Tubulina se encuentra disminuida en el grupo db/db (0.727 ± 0.007) en comparación con los dos grupos de ratones sanos WT y WT+C (1.0 ± 0.039 y 0.916 ± 0.06, respectivamente). La curcumina incrementó la proporción de expresión de PPARγ en el grupo db/db+C (1.505 ± 0.045), sugiriendo así un efecto benéfico, incrementando la expresión de PPARγ hasta un nivel mayor que el de los ratones sanos.
|
| |
 |
| |
Figura 5. Efecto de la curcumina sobre la expresión de PPARγ en hígado de los ratones. *vs. WT, p < 0.01; $vs. WT y WT+C, p < 0.001; %vs. db/db, p < 0.001.
Fuente: Elaboración propia. |
 |
Figura 5. Efecto de la curcumina sobre la expresión de PPARγ en hígado de los ratones. *vs. WT, p < 0.01; $vs. WT y WT+C, p < 0.001; %vs. db/db, p < 0.001.
Fuente: Elaboración propia. Close |
La figura 6 muestra mayor proporción de expresión de NF-κB/Tubulina en los ratones db/db y db/db+C (1.185 ± 0.026 y 1.044 ± 0.045, respectivamente) que en los ratones sanos WT y WT+C (1.0 ± 0.019 y 0.944 ± 0.048, respectivamente). La curcumina disminuyó la proporción de expresión de NF-κB en el grupo db/db+C, con respecto al grupo db/db (p < 0.05).
|
| |
 |
| |
Figura 6. Efecto de la curcumina sobre la expresión de p65 NFκB en hígado de los ratones. *vs. WT, p < 0.05; $vs. WT+C, p < 0.005; &vs. db/db+C, p < 0.05. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. |
 |
Figura 6. Efecto de la curcumina sobre la expresión de p65 NFκB en hígado de los ratones. *vs. WT, p < 0.05; $vs. WT+C, p < 0.005; &vs. db/db+C, p < 0.05. Los resultados se muestran como la media ± EE.
Fuente: Elaboración propia. Close |
DISCUSIÓN
Durante el tiempo de tratamiento, los ratones diabéticos perdieron peso. Esta pérdida fue menor en los ratones tratados con curcumina, aunque no se alcanzó una diferencia significativa. Otros estudios han reportado en modelos murinos alimentados con dieta alta en grasa, en diabéticos y en humanos, que la suplementación con curcumina disminuye y/o previene la ganancia del peso corporal (Chuengsamarn, Rattanamongkolgul, Luechapudiporn, Phisalaphong & Jirawatnotai, 2012; Jang et al., 2008). Sin embargo, se debe considerar la edad del ratón, y con respecto a la curcumina, la dosis, el tiempo de tratamiento y la vía de administración empleada.
En el presente estudio se utilizaron ratones de 15 semanas de edad, edad a la cual la hiperglucemia ha causado alteraciones metabólicas serias que se ve reflejado en una pérdida acelerada de peso. Probablemente el tratamiento con curcumina ayuda a disminuir estas alteraciones, lo que se ve reflejado en menor pérdida de peso en los ratones diabéticos a las 23 semanas de edad que concluyó el estudio. Esto es apoyado por un estudio realizado en ratones sanos y db/db que fueron alimentados con curcuminan (0.02%) durante seis semanas, el tratamiento con curcumina previno la pérdida de peso (Seo et al., 2008).
En humanos, los niveles máximos de curcumina en suero se alcanzan de una a dos horas después de la ingesta oral y disminuyen gradualmente en las siguientes 12 h (Cheng et al., 2001). En una prueba de tolerancia a la glucosa en ratones obesos se observó que la curcumina (50 mg/kg) a partir de los 30 min disminuye los niveles de glucosa en sangre, y a los 120 min los niveles se observan por debajo de los 15 nmol/L (He et al., 2012). En el presente estudio, los valores reportados corresponden aproximadamente a 6 h después de la última ingesta de curcumina (20 mg/ratón/día), lo cual sugiere que a este tiempo ya pasó el efecto normo-glucemiante de la misma, razón por la cual no encontramos efecto de la curcumina sobre la concentración sanguínea de glucosa en los ratones diabéticos.
La expresión de AMPK se encontró disminuida en los ratones db/db como se ha reportado en tejidos periféricos como el corazón, músculo esquelético e hígado en modelos de obesidad en roedores (Steinberg & Kemp, 2009). Varios estudios han demostrado que los polifenoles, como el resveratrol, estimulan la actividad de AMPK en varios tipos celulares (Zang et al., 2006), como ocurrió con la curcumina en hígado de ratón diabético en el presente estudio. El aumento en la expresión de AMPK en los ratones diabéticos es importante, ya que en el hígado AMPK inhibe la producción hepática de glucosa y la lipogénesis, procesos afectados en obesidad y DM2 (Oakhill et al., 2012; Yu et al., 2004), además, la AMPK está relacionada con la activación de la SIRT1 (Hou, et al., 2008; Lan et al., 2008).
La expresión de la SIRT1 está disminuida en diferentes tejidos con DM2 (De Kreutzenberg et al., 2010; Gillum et al., 2011). La disminución de la SIRT1 en los ratones diabéticos observada en el presente estudio podría contribuir al desarrollo de las alteraciones relacionadas con DM2. Así, la activación de SIRT1 se considera una estrategia terapéutica potencial para la diabetes. En este trabajo no se encontró efecto de la curcumina sobre la expresión de la SIRT1, pero se ha sugerido que la curcumina, al igual que el resveratrol, ejerce una activación indirecta de la SIRT1, a través de AMPK (Ruderman et al., 2010). Las funciones de SIRT1 son variadas, y tejido específicas regula la transcripción de genes y múltiples vías de señalización metabólicas. Por ejemplo, regula la actividad transcripcional de PPARγ (Chung et al., 2010; Lomb, Laurent & Haigis, 2010).
El PPARγ pertenece a la categoría de las proteínas reguladas por SIRT1, el cual es un regulador del metabolismo de lípidos y glucosa en el tejido adiposo, el músculo, el corazón y el hígado (Picard & Auwerx, 2002). La disminución de la expresión de PPARγ en los ratones diabéticos observada en el presente estudio concuerda con lo anterior, considerando que el metabolismo hepático de la glucosa se encuentra alterado en condición de diabetes (Nandi, Kitamura, Kahn & Accili, 2004). Por lo tanto, se considera a PPARγ como un blanco terapéutico para el tratamiento de la DM2. El efecto que la curcumina ejerce sobre PPARγ no se conoce completamente y está poco estudiado. Los resultado de este trabajo demuestran que la curcumina incrementó la expresión de PPARγ, como se ha reportado en fibrosis hepática (Lin, Tang, Kang, Feng & Chen, 2012). Esto sugiere que la curcumina tiene un efecto similar a las tiazolinedionas (TZD), un grupo de fármacos que son agonistas de PPARγ y sensibilizantes a la insulina, por lo cual son usados en el tratamiento de la DM2.
El incremento en la expresión de NF-κB encontrado en los ratones diabéticos concuerda con lo reportado para la inflamación, la obesidad y la resistencia a la insulina (Arkan et al., 2005; Cai et al., 2005). La curcumina disminuyó la expresión de NF-κB en los ratones diabéticos, como ha ocurrido en diferentes tejidos (Weisberg, Leibel & Tortoriello, 2008) y en células mieloides humanas ML-1a (Singh & Aggarwal, 1995). La disminución en la expresión de NF-κB en los ratones diabéticos es importante, ya que éste es un factor clave que dispara y aumenta la respuesta inflamatoria crónica. Esto lo hace un blanco terapéutico importante para el tratamiento de la obesidad y la diabetes, y la curcumina logró disminuir su expresión.
En conjunto, el aumento de la expresión de AMPK observado probablemente activa a la SIRT1 y ésta, a su vez, activa a PPARγ e incrementa su expresión, regulando así la expresión de diversos genes relacionados con el metabolismo de la glucosa y los ácidos grasos, entre otros. Además, los resultados de este trabajo también sugieren que la curcumina tiene efecto benéfico a través de la disminución de la expresión de NF-κB en los ratones diabéticos, lo cual se traduce en la disminución de la inflamación presente en la obesidad y DM2.
AGRADECIMIENTOS
Esta investigación fue financiada por la Dirección de Apoyo a la Investigación y al Posgrado (DAIP), de la Universidad de Guanajuato. Una de las autoras, Lizbeth M. Jiménez Flores, obtuvo una beca del Consejo Nacional de Ciencia y Tecnología (Conacyt) para estudios de maestría (269733).
REFERENCES
Al-Mukhtar, S. B , Fadhil N. N & Hanna B. E (2012). General and gender characteristics of type 2 diabetes mellitus among the younger and older age groups. Oman Medical Journal, 27(5), 375-382.
Alappat, L. & Awad, A. B (2010). Curcumin and obesity: evidence and mechanisms. Nutrition Reviews, 68(12), 729-738.
Arkan, M. C., Hevener, A. L., Greten, F. R., Maeda, S., Li, Z. W., Long, J. M., Wynshaw-Boris, A., Poli, G., Olefsky, J. & Karin, M. (2005). IKK-beta links inflammation to obesity-induced insulin resistance. Nature Medicine, 11(2), 191-198.
Barrera-Cruz, A., Rodríguez-González, A. & Molina-Ayala, M. A. (2013). The current state of obesity in Mexico. Revista Médica del Instituto Mexicano del Seguro Social, 51(3), 292-299.
Cai, D., Yuan, M., Frantz, D. F., Melendez, P. A., Hansen, L., Lee, J. & Shoelson, S. E. (2005). Local and systemic insulin resistance resulting from hepatic activation of IKK-beta and NF-kappaB. Nature Medicine, 11(2), 183-190.
Cheng, A. L., Hsu, C. H., Lin, J. K., Hsu, M. M., Ho, Y. F., Shen, T. S., Ko, J. Y., Lin, J. T., Lin, B. R., Ming-Shiang, W., Yu, H. S., Jee, S. H., Chen, G. S., Chen, T. M., Chen, C. A., Lai, M. K., Pu, Y. S., Pan, M. H., Wang, Y. J., Tsai, C. C. & Hsieh, C. Y. (2001). Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions. Anticancer Research, 21(4B), 2895-2900.
Chuengsamarn, S., Rattanamongkolgul, S., Luechapudiporn, R., Phisalaphong, C. & Jirawatnotai, S. (2012). Curcumin extract for prevention of type 2 diabetes. Diabetes Care, 35(11), 2121-2127.
Chung, S., Yao, H., Caito, S., Hwang, J. W., Arunachalam, G. & Rahman, I (2010). Regulation of SIRT1 in cellular functions: role of polyphenols. Archives of Biochemistry and Biophysic, 501(1), 79-90.
De Kreutzenberg, S. V., Ceolotto, G., Papparella, I., Bortoluzzi, A., Semplicini, A., Dalla Man, C., Cobelli, C., Fadini, G. P. & Avogaro, A. (2010). Downregulation of the longevity-associated protein sirtuin 1 in insulin resistance and metabolic syndrome: potential biochemical mechanisms. Diabetes, 59(4), 1006-1015.
Franco-Robles, E., Campos-Cervantes, A., Murillo-Ortiz, B. O., Segovia, J., López-Briones, S., Vergara, P., Pérez-Vázquez, V., Solis-Ortiz, M. S. & Ramírez-Emiliano, J. (2013). Effects of curcumin on brain-derived neurotrophic factor levels and oxidative damage in obesity and diabetes. Applied Physiology, Nutrition, and Metabolism, 39(2), 211-218.
Gillum, M. P., Kotas, M. E., Erion, D. M., Kursawe, R., Chatterjee, P., Nead, K. T., Muise, E. S., Hsiao, J. J., Frederick, D. W., Yonemitsu, S., Banks, A. S., Qiang, L., Bhanot, S., Olefsky, J. M., Sears, D. D., Caprio, S. & Shulman, G. I. (2011). SirT1 regulates adipose tissue inflammation. Diabetes, 60(12), 3235-3245.
Gupta, S. C., Patchva, S., Koh, W. & Aggarwal, B. B. (2012). Discovery of curcumin, a component of golden spice, and its miraculous biological activities. Clinical and Experimental Pharmacology and Physiology, 39(3), 283-299.
He, H. J., Wang, G. Y., Gao, Y., Ling, W. H., Yu, Z. W. & Jin, T. R (2012). Curcumin attenuates Nrf2 signaling defect, oxidative stress in muscle and glucose intolerance in high fat diet-fed mice. World Journal of Diabetes, 3(5), 94-104.
Hou, X., Xu, S., Maitland-Toolan, K. A., Sato, K., Jiang, B., Ido, Y., Lan, F., Walsh, K., Wierzbicki, M., Verbeuren, T. J., Cohen, R. A. & Zang, M. (2008). SIRT1 regulates hepatocyte lipid metabolism through activating AMP-activated protein kinase. Journal of Biological Chemistry, 283(29), 20015-20026.
Hurkman, W. J. & Tanaka, C. K. (1986). Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis. Plant Physiology, 81(3), 802-806.
Jang, E. M., Choi, M. S., Jung, U. J., Kim, M. J., Kim, H. J., Jeon, S. M., Shin, S. K., Seong, C. N. & Lee, M. K. (2008). Beneficial effects of curcumin on hyperlipidemia and insulin resistance in high-fat-fed hamsters. Metabolism, 57(11), 1576-1583.
Lan, F., Cacicedo, J. M., Ruderman, N. & Ido, Y. (2008). SIRT1 modulation of the acetylation status, cytosolic localization, and activity of LKB1. Possible role in AMP-activated protein kinase activation. Journal Biological Chemistry, 283(41), 27628-27635.
Lin, J., Tang, Y., Kang, Q., Feng, Y. & Chen, A. (2012). Curcumin inhibits gene expression of receptor for advanced glycation end-products (RAGE) in hepatic stellate cells in vitro by elevating PPARγ activity and attenuating oxidative stress. British Journal fo Pharmacology, 166(8), 2212-2227.
Lomb, D. J., Laurent, G. & Haigis, M. C. (2010). Sirtuins regulate key aspects of lipid metabolism. Biochimica et Biophysica Acta, 1804(8), 1652-1657.
Martinez-Morua, A., Soto-Urquieta, M. G., Franco-Robles, E., Zuniga-Trujillo, I., Campos-Cervantes, A., Pérez-Vázquez, V. & Ramírez-Emiliano, J. (2013). Curcumin decreases oxidative stress in mitochondria isolated from liver and kidneys of high-fat diet-induced obese mice. Journal of Asian Natural Products Research, 15(8), 905-915.
Nandi, A., Kitamura, Y., Kahn, C. R. & Accili, D. (2004). Mouse models of insulin resistance. Physiological Reviews, 84(2), 623-647.
Oakhill, J. S., Scott, J. W. & Kemp, B. E. (2012). AMPK functions as an adenylate charge-regulated protein kinase. Trends in Endocrinology & Metabolism, 23(3), 125-132.
Picard, F. & Auwerx, J. (2002). PPAR(gamma) and glucose homeostasis. Annual Review of Nutrition, 22(1), 167-197.
Picard, F., Kurtev, M., Chung, N., Topark-Ngarm, A., Senawong, T., Machado De Oliveira, R., Leid, M., McBurney, M. W. & Guarente, L. (2004). Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma. Nature, 429(6993), 771-776.
Rodgers, J. T., Lerin, C., Haas, W., Gygi, S. P., Spiegelman, B. M. & Puigserver, P. (2005). Nutrient control of glucose homeostasis through a complex of PGC-1alpha and SIRT1. Nature, 434(7029), 113-118.
Ruderman, N. B., Xu, X. J., Nelson, L., Cacicedo, J. M., Saha, A. K., Lan, F. & Ido, Y. (2010). AMPK and SIRT1: a long-standing partnership? American Journal of Physiology Endocrinology and Metabolism, 298(4), E751-E760.
Seo, K. I., Choi, M. S., Jung, U. J., Kim, H. J., Yeo, J., Jeon, S. M. & Lee, M. K. (2008). Effect of curcumin supplementation on blood glucose, plasma insulin, and glucose homeostasis related enzyme activities in diabetic db/db mice. Molecular Nutrition & Food Research, 52(9), 995-1004.
Shehzad, A. & Lee, Y. S. (2013). Molecular mechanisms of curcumin action: signal transduction. Biofactors, 39(1), 27-36.
Singh, S. & Aggarwal, B. B. (1995). Activation of transcription factor NF-kappa B is suppressed by curcumin (diferuloylmethane) [corrected]. Journal of Biological Chemistry, 270(42), 24995-25000.
Steinberg, G. R. & Kemp, B. E. (2009). AMPK in Health and Disease. Physiological Reviews, 89(3), 1025-1078.
Weisberg, S. P., Leibel, R. & Tortoriello, D. V. (2008). Dietary curcumin significantly improves obesity-associated inflammation and diabetes in mouse models of diabesity. Endocrinology, 149(7), 3549-3558.
Xu, H., Barnes, G. T., Yang, Q., Tan, G., Yang, D., Chou, C. J., Sole, J., Nichols, A., Ross, J. S., Tartaglia, L. A. & Chen, H. (2003) Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. Journal of Clinical Investigation, 112(12), 1821-1830.
Yu, X., McCorkle, S., Wang, M., Lee, Y., Li, J., Saha, A. K., Unger, R. H. & Ruderman, N. B. (2004). Leptinomimetic effects of the AMP kinase activator AICAR in leptin-resistant rats: prevention of diabetes and ectopic lipid deposition. Diabetologia, 47(11), 2012-2021.
Zang, M., Xu, S., Maitland-Toolan, K. A., Zuccollo, A., Hou, X., Jiang, B., Wierzbicki, M., Verbeuren, T. J. & Cohen, R. A. (2006). Polyphenols stimulate AMP-activated protein kinase, lower lipids, and inhibit accelerated atherosclerosis in diabetic LDL receptor-deficient mice. Diabetes, 55(8), 2180-2191.
Zhang, D. W., Fu, M., Gao, S. H. & Liu, J. L. (2013). Curcumin and Diabetes: A Systematic Review. Evidence Based Complementary and Alternative Medicine, 2013(1), 1-16.