RESUMEN
La infección por Helicobacter pylori es el principal factor de riesgo para cáncer gástrico; en la respuesta inmune inducida por la bacteria existe un infiltrado de células que secretan citocinas, favoreciendo el desarrollo de la carcinogénesis gástrica. El objetivo fue evaluar la relación de la expresión de IFN-γ e IL-4 con la infección por H. pylori, gastritis crónica y cáncer gástrico. Se incluyeron 100 pacientes con gastritis crónica y 20 con cáncer gástrico; se determinó la expresión de INF-γ e IL-4 por inmunohistoquímica. El 57.5% de los casos fueron positivos a H. pylori, la mayor frecuencia de expresión de IFN-γ se encontró en los casos de cáncer positivos a la bacteria, en el caso de IL-4 se encontró más frecuente en gastritis crónica H. pylori positivo. Se localizó mayor frecuencia de expresión de IFN-γ en comparación con IL-4; en la mayoría de las muestras positivas a H. pylori expresaron las dos citocinas.
ABSTRACT
The Helicobacter pylori infection is the main factor of risk for gastric cancer, in the immune response induced for the bacterium there is an infiltration of cells which produce high levels of cytokines, which may be involved in gastric carcinogenesis. The objetive of this investigation is to evaluate the relation of the expression of IFN-γ and IL-4 with the H. pylori infection, chronic gastritis and gastric cancer. 100 patients with chronic gastritis and twenty with gastric cancer were included; the expression of INF-γ and IL-4 was determined by immunohistochemistry. 57.5% of cases were positive for H. pylori, the highest frequency of IFN-γ expression was found in cases of cancer H. pylori-positive, in the case of IL-4 was more frequent in patients H. pylori-positive with chronic gastritis. The IFN-γ expression frequency was higher than the IL-4 expression. In the majority of the samples H. pylori-positive were expressed the two cytokines.
INTRODUCCIÓN
El adenocarcinoma gástrico es uno de los tumores más frecuentes, independientemente de la edad, la raza o los factores predisponentes que presente el paciente (Rosai, 2011). El país con mayor prevalencia de cáncer gástrico es Japón; y en países de Latinoamérica, donde se ha notificado una de las incidencias más elevadas, es en Chile con 23.6% y en Colombia con 13%, mientras que en México se aproxima al 8% (Rojas-Pedraza, Sobrino-Cossío, Hernández-Guerrero, Alonso-Lárraga & Zeichner-Gancz, 2007). El cáncer gástrico es multifactorial, se asocia a la predisposición genética y a la respuesta inmunológica del huésped, así como a otros factores como el estilo de vida, el alto consumo de alimentos salados, obesidad, alcoholismo y tabaquismo, así como a los factores de virulencia de Helicobacter pylori (Lee, Kim, Cheong & Noh, 2012; Namiot, Kemona & Namiot, 2007).
H. pylori es una bacteria microaerofílica, flagelada, Gram-negativa, que coloniza específicamente el epitelio gástrico (Romero-Adrian et al., 2010). Esta bacteria posee factores de virulencia que le confieren la capacidad de dañar el tejido gástrico. La isla de patogenicidad cag (cag PAI), que codifica para un sistema de secreción tipo IV (T4SS) y que contiene el gen cagA, transloca la proteína oncogénica efectora, CagA. Cag-PAI está asociada con daño al tejido y riesgo de padecer enfermedades graves como úlcera y cáncer gástrico (Wroblewski, Peek, & Wilson, 2010). VacA es una proteína secretada con efecto vacuolizante en varias líneas celulares, incluyendo células gástricas. El genotipo vacA s1/m1 se asocia con inflamación aumentada y con mayor riesgo de desarrollar cáncer (Fox & Wang, 2007).
Cuando la infección por H. pylori persiste, favorece el establecimiento de un cuadro inflamatorio crónico, posiblemente causante del daño del epitelio gástrico que posteriormente puede progresar en cáncer (Ihan, Pinchuk & Beswick, 2012).
La inflamación inicia en el epitelio con el reconocimiento de patrones moleculares asociados a patógenos (PAMP’s) como el lipopolisacarido (LPS), que es una molécula con actividad endotóxica (Kusters, Van Vliet & Kuipers, 2006). El LPS estimula a las células del epitelio gástrico para secretar IL-8, un quimioatrayente de leucocitos que conduce al aumento en la infiltración de polimorfonucleares, linfocitos y macrófagos (Fuentes, Camorlinga & Maldonado, 2009).
Además, las células del infiltrado inflamatorio producen concentraciones elevadas de citocinas proinflamatorias TNF-$\alpha$ , IL-6, IL-1β, IL-12, IL-10 e IFN-γ; esta respuesta provoca cambios en la fisiología del estómago, por daño directo a las células o regulación de la proliferación celular y la apoptosis (Fuentes et al., 2009). Todo esto tiene como consecuencia un daño directo en la mucosa epitelial, lo cual desempeña un papel importante en la carcinogénesis gástrica (Chitcholtan, Hampton & Keenan, 2008). IFN-γ ayuda a disminuir la colonización por H. pylori, pero al mismo tiempo la sobreexpresión de esta citocina en la mucosa gástrica promueve una respuesta inflamatoria prolongada conduciendo desde gastritis superficial a gastritis crónica, úlcera y posteriormente cáncer (Zhao et al., 2011). IL-4 participa en el proceso de la inflamación que medía la carcinogénesis de órganos humanos, incluyendo el tracto gastrointestinal. IL-4 es una potente citocina anti-apoptótica, factor de supervivencia para las células tumorales, y puede proteger a las células tumorales de la apoptosis inducida por varios agentes, incluidos los utilizados en terapias antitumorales. Por lo tanto, es posible que la IL-4 participe en la resistencia a tratamientos contra el cáncer (Zamorano, Rivas & Pérez, 2003). El objetivo fue evaluar la relación de la expresión de IFN-γ e IL-4 con la infección por H. pylori, gastritis crónica y cáncer gástrico.
MATERIALES Y MÉTODOS
Se seleccionaron a los pacientes que estuvieron de acuerdo en participar en el estudio. Se obtuvieron biopsias gástricas del sitio de lesión, una se utilizó para la identificación molecular de H. pylori y a la otra se le realizó inmunohistoquímica para observar la expresión de IFN-γ e IL-4. Se realizó la extracción de DNA a partir de las biopsias gástricas, por el método de Trizol, se añadió 1 ml de este reactivo por cada 50 ng -100 ng de tejido, posteriormente se añadieron 200 uL de cloroformo por cada mililitro de trizol. Se cuantificó el DNA genómico en el biofotómetro (Eppendorf Biofhotometer 22331, Hamburg, Germany), donde se determinó la concentración y pureza, utilizando una dilución de 1:100.
Detección de H. pylori por PCR
La identificación de H. pylori se realizó empleando los siguientes oligonucleótidos: HP16-219 5´-GCTAAGAGATCAGCCTATGTCC-3´ y HPGR16SR 5´- CAATCAGCGTCAGTAATGTTC´3, que amplifican una región de 522 pb del gen RNAr 16S de la bacteria. La mezcla de reacción tuvo un volumen final de 15 µL, que contenía 2.5 mM de MgCl2, 2.5 mM de dNTP’s, 5 pmol de cada oligonucleótido, 1 U de Taq DNA polimerasa Platinium (Invitrogen, Brasil) y 150 ng de DNA total. El programa de amplificación incluyó: un ciclo de desnaturalización inicial a 94 °C por 5 min, 40 ciclos a 94 °C por 30 s, 55 °C por 30 s y 72 °C por 1 min, y un ciclo de extensión final a 72 °C por 7 min. Los productos de PCR se sometieron a electroforesis en gel de agarosa al 1.5%, se tiñeron con bromuro de etidio y se visualizaron con luz ultravioleta (UV) en un transiluminador (BIORAD).
Detección de IFN-γ e IL-4 por inmunohistoquímica
Las biopsias fueron incluidas en parafina. Se realizaron cortes de 3 µm, después de la permeabilización y el bloqueo de la peroxidasa endógena; los cortes se incubaron durante 22 h con los anticuerpos monoclonales de ratón anti-IFN-γ y anti-IL-4 humano (Santa Cruz Biotechnology, Santa Cruz, USA) dilución 1:50 y 1:500, respectivamente. La unión del anticuerpo fue detectada con el Kit Mouse/Rabbit ImmunoDetector HRP/DAB Detection System (Bio SB, Santa Barbara, CA, USA). Se realizó una contratinción con hematoxilina (Biocare Medical, Concord, CA, USA). Las células mononucleares con tinción nuclear y citoplasmática distinta se consideraron positivas.
RESULTADOS
Determinación de H. pylori
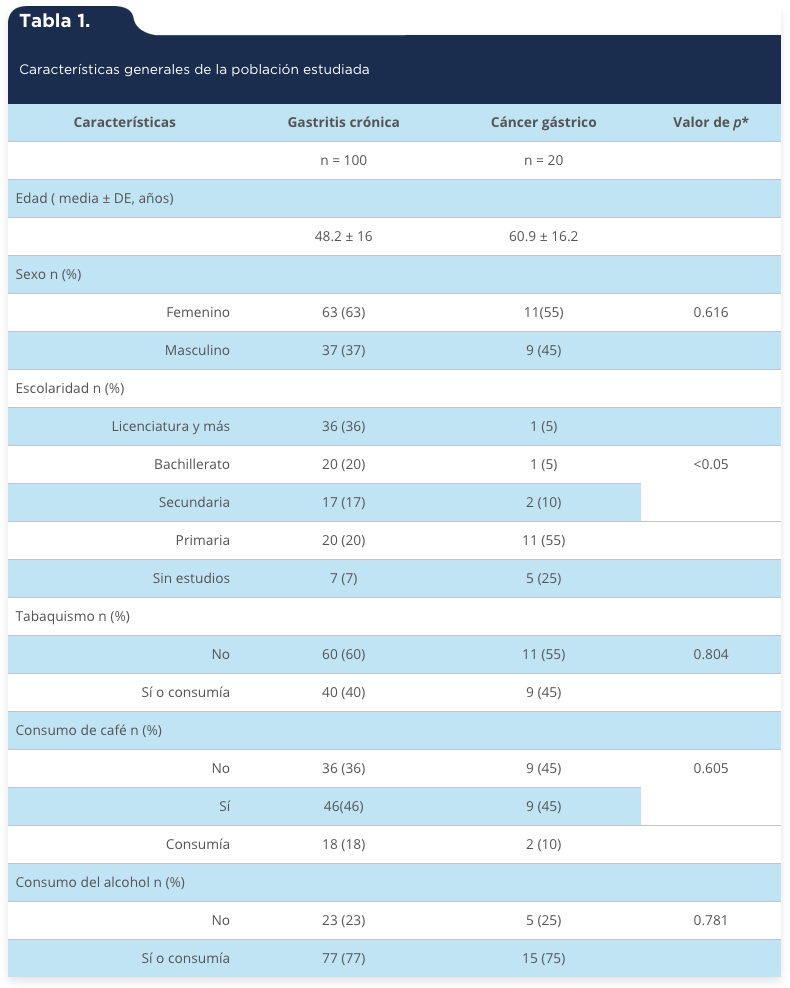
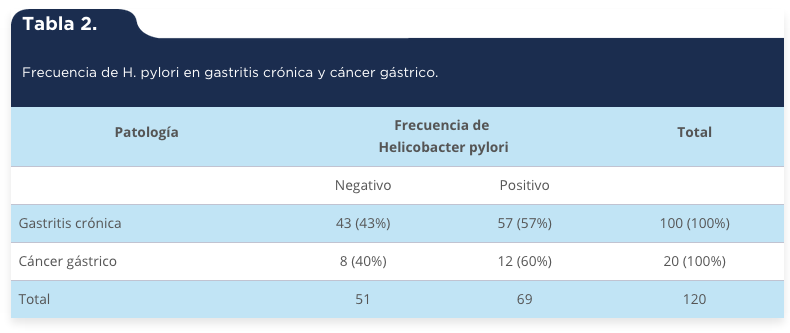
En el estudio se incluyeron 120 pacientes, 100 con diagnóstico endoscópico e histopatológico de gastritis crónica y 20 de cáncer gástrico. Hubo una mayor participación del sexo femenino (n = 74). En los casos de gastritis crónica la edad media fue de 48 años, con un intervalo de 19 a 80 años; en los pacientes con cáncer gástrico la media de edad fue de 60 años con un intervalo de 31 a 85 años, las características generales de la población se muestran en la tabla 1. Se determinó la presencia de H. pylori en todos los casos, donde se encontró que hubo más casos positivos en cáncer gástrico (tabla 2).
Tabla 1.
Características generales de la población estudiada
|
|
Características
|
Gastritis crónica
|
Cáncer gástrico
|
Valor de p*
|
|
n = 100
|
n = 20
|
|
|
Edad ( media ± DE, años)
|
|
48.2 ± 16
|
60.9 ± 16.2
|
|
|
Sexo n (%)
|
|
Femenino
|
63 (63)
|
11(55)
|
0.616
|
|
Masculino
|
37 (37)
|
9 (45)
|
|
|
Escolaridad n (%)
|
|
Licenciatura y más
|
36 (36)
|
1 (5)
|
|
|
Bachillerato
|
20 (20)
|
1 (5)
|
<0.05
|
|
Secundaria
|
17 (17)
|
2 (10)
|
|
Primaria
|
20 (20)
|
11 (55)
|
|
|
Sin estudios
|
7 (7)
|
5 (25)
|
|
|
Tabaquismo n (%)
|
|
No
|
60 (60)
|
11 (55)
|
0.804
|
|
Sí o consumía
|
40 (40)
|
9 (45)
|
|
|
Consumo de café n (%)
|
|
No
|
36 (36)
|
9 (45)
|
0.605
|
|
Sí
|
46(46)
|
9 (45)
|
|
Consumía
|
18 (18)
|
2 (10)
|
|
|
Consumo del alcohol n (%)
|
|
No
|
23 (23)
|
5 (25)
|
0.781
|
|
Sí o consumía
|
77 (77)
|
15 (75)
|
|
*X2. n = Tamaño de la muestra.
Fuente: Elaboración propia con base en los resultados del estudio.
Abrir
 |
*X2. n = Tamaño de la muestra.
Fuente: Elaboración propia con base en los resultados del estudio.
Close |
Tabla 2.
Frecuencia de H. pylori en gastritis crónica y cáncer gástrico.
|
|
Patología
|
Frecuencia de
Helicobacter pylori
|
Total
|
|
Negativo
|
Positivo
|
|
|
Gastritis crónica
|
43 (43%)
|
57 (57%)
|
100 (100%)
|
|
Cáncer gástrico
|
8 (40%)
|
12 (60%)
|
20 (100%)
|
|
Total
|
51
|
69
|
120
|
Expresión de INF-γ e IL-4.
Fuente: Elaboración propia con base en los resultados del estudio.
Abrir
 |
Expresión de INF-γ e IL-4.
Fuente: Elaboración propia con base en los resultados del estudio. Close |
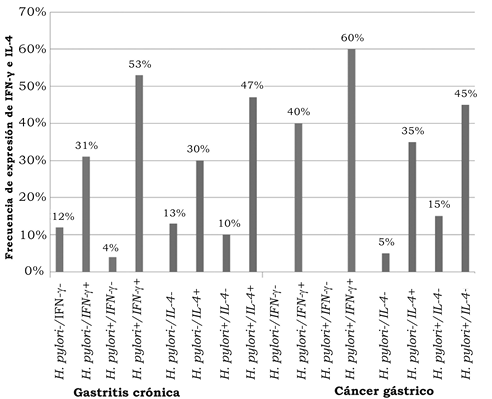
La mayoría de las muestras analizadas expresaron IFN-γ (104/120) e IL-4 (93/120); los 20 casos de cáncer gástrico expresaron IFN-γ, de éstas, 60% de las muestras fueron positivas para H. pylori; el 80% de las muestras de cáncer tanto H. pylori-negativas como H. pylori-positivas expresaron IL-4. Los datos de la expresión de ambas citocinas en el grupo de gastritis crónica se muestran en la figura 1.
|
| |
 |
| |
Figura 1. Expresión de INF-γ e IL-4 en pacientes H. pylori-negativos y H. pylori-positivos con gastritis crónica y cáncer gástrico
Fuente: Elaboración propia con base en los resultados del estudio. |
 |
Figura 1. Expresión de INF-γ e IL-4 en pacientes H. pylori-negativos y H. pylori-positivos con gastritis crónica y cáncer gástrico
Fuente: Elaboración propia con base en los resultados del estudio. Close |
DISCUSIÓN
H. pylori es el principal factor de riego para el desarrollo de cáncer gástrico; la erradicación de esta bacteria disminuye significativamente el riesgo de desarrollar cáncer en individuos infectados sin lesiones pre-malignas, lo que refuerza el principio de que este organismo influye en las primeras etapas de la carcinogénesis gástrica (Wen & Moss, 2009). En el presente estudio se evaluó la expresión de IFN-γ e IL-4 en gastritis crónica y cáncer gástrico con y sin infección por H. pylori, observando una frecuencia de infección del 57% (57/100) en los pacientes con gastritis crónica y del 60% (12/20) en pacientes con cáncer gástrico, encontrando que en la mayoría de los casos de gastritis crónica H. pylori-positivos hubo una mayor frecuencia de expresión de IFN-γ en comparación con los H. pylori-negativos, contrario a lo encontrado en los casos de cáncer gástrico donde tanto H. pylori positivos como negativos expresaron IFN-γ. Por otro lado, se encontró que la expresión de IL-4 tuvo un comportamiento similar al de INF-γ, encontrándose una mayor frecuencia de expresión de IL-4 en pacientes H. pylori-positivos comparados con los H. pylori-negativos, tanto en gastritis crónica como en cáncer gástrico.
Karttunen, Karttunen, Ekre & Macdonald (1995) no hallaron diferencias entre la frecuencia de células secretoras de IL-4 en gastritis y mucosa gástrica no inflamada, además de que no observaron un aumento de las células secretoras de IL-4 en pacientes H. pylori positivo y negativo con gastritis. En otro estudio, Wang et al. (2007) encontraron que la expresión de IFN-γ iba disminuyendo conforme la patología gástrica evolucionaba a cáncer gástrico, es decir, que había mayor expresión de IFN-γ en pacientes con gastritis que en los pacientes con cáncer gástrico y que la expresión de IL-4 era mayor en los pacientes con cáncer gástrico que los pacientes con gastritis crónica; cabe señalar que todos los pacientes incluidos en el estudio de Wang et al. (2007) fueron H. pylori-positivos. Hosseini et al. (2010) encontraron que existía un aumento en la expresión de IFN-γ en mucosa gástrica de pacientes con cáncer gástrico en comparación con los pacientes con dispepsia no ulcerosa y úlcera péptica. En un estudio hecho en ratones, los cuales fueron infectados con H. felis, Zavros et al. (2003) encontraron que la gastrina y somatostatina son péptidos regulados por IFN-γ e IL-4, respectivamente. El mecanismo del efecto anti-inflamatorio de IL-4 es a través del aumento de la expresión y liberación de somatostatina de las células D gástricas. Además, mostraron que la expresión de la gastrina es inducida por IFN-γ, una citocina pro-inflamatoria. Estos resultados implican que los cambios recíprocos de la gastrina y la somatostastina durante la infección por Helicobacter en humanos pueden ser debido a un aumento en la expresión de IFN-γ durante una gastritis mediada por Th1 y no debido a un efecto directo del microorganismo (Zavros et al., 2003). Los resultados encontrados en este estudio coinciden con lo reportado por Abdollahi et al. (2011), quienes reportaron que los niveles de INF-γ en mucosa gástrica de pacientes infectados por H. pylori fueron más altos que en aquellos pacientes H. pylori negativos.
En conclusión, en este estudio se encontró que la frecuencia de expresión de IFN-γ fue mayor en comparación con la de IL-4; se observó una mayor frecuencia de expresión de ambas citocinas en pacientes H. pylori-positivos, tanto en gastritis crónica como en cáncer gástrico.
AGRADECIMIENTOS
La investigación se realizó con financiamiento de la Universidad Autónoma de Guerrero, convocatoria 2013, por tal motivo se extiende un sincero agradecimiento a dicha institución educativa.
REFERENCES
Abdollah, H., Sham, S., Zahedi, M. J. , Moghadam, S. D., Hayatbakhsh, M. M. & Jafarzadeh, A. (2011). IL-10, TNF-a and IFN-γ Levels in Serum and Stomach Mucosa of Helicobacter Pylori-Infected Patients. Iran Journal Allergy Asthma Immunology, 10(4), 267-271.
Chitcholtan, K., Hampton, M. & Keenan, I. (2008). Outer membrane vesicles enhance the carcinogenic potential of Helicobacter pylori. Carcinogenesis, 29(12), 2400-2405.
Fox, J. G. & Wang, T. C. (2007). Inflammation, atrophy, and gastric cancer. Journal of Clinical Investigation, 117(1), 60-69.
Fuentes, P. E., Camorlinga, P. M. & Maldonado B. C. (2009). Infection, inflammation and gastric cancer. Salud Pública de México, 51(5), 427-433.
Hosseini, E., Oghalaie, A., Habibi, G., Nahvijoo, A., Hosseini, Z. M, Tashakoripoor, M. & Mohammadi, M. (2010). Molecular detection of host cytokine expression in Helicobacter pylori infected patients via semi-quantitative RT-PCR. Biotechnology Research Center, 28(1), 40-44.
Ihan, A., Pinchuk, I. V. & Beswick, E. J. (2012). Inflammation, immunity, and vaccines for Helicobacter pylori infection. Helicobacter, 17(Suppl. 1), 16-21.
Karttunen, R., Karttunen, T., Ekre, H. P. & Macdonald, T. T. (1995). Interferon gamma and interleukin 4 secreting cells in the gastric antrum in Helicobacter pylori positive and negative gastritis. Gut, 36(3), 341-345.
Kusters, J. G., Van Vliet, A. H. & Kuipers, E. J. (2006). Pathogenesis of Helicobacter pylori infection. Clinical Microbiology Reviews, 19(3), 449-490.
Lee, J. H., Kim, K. M., Cheong, J. H., Noh, S. H. (2012). Current management and future strategies of gastric cancer. Yonsei Medical Journal, 53(2), 248-57.
Namiot, A., Kemona, A. & Namiot, Z. (2007). Smoking habit and gastritis histology. Advances in Medical Sciences, 52, 191-195.
Rojas-Pedraza, O., Sobrino-Cossío, S., Hernández-Guerrero, A., Alonso-Lárraga, J. O. & Zeichner-Gancz, I. (2007). Supervivencia en cáncer gástrico en el Instituto Nacional de Cancerología. Endoscopía, 19(4), 330-338.
Romero-Adrian, T. B., Leal, M. J., Monsalve, C. F., Mengual, M. E., Mcgregor, E. G., Perini, L. & Antúnez, A. (2010). Helicobacter pylori: bacterial factors and the role of cytokines in the immune response. Current Microbiology, 60(2), 143-155.
Rosai, J. (2011). Rosai and Ackerman's Surgical Pathology (10th ed.). St. Louis: Mosby Press.
Wang, S. K., Zhu, H. F., He, B. S., Zhang, Z. Y., Chen, Z. T., Wang, Z. Z. & Wu, G. L. (2007). CagA+ H. pylori infection is associated with polarization of T helper cell immune responses in gastric carcinogenesis. World Journal Gastroenterology, 13(13), 2923-2931.
Wen, S. & Moss, S. F. (2009). Helicobacter pylori virulence factors in gastric carcinogenesis. Cancer Lett, 282(1), 1-8.
Wroblewski, L. E., Peek, R. M., Jr. & Wilson, K. T. (2010). Helicobacter pylori and gastric cancer: factors that modulate disease risk. Clinical Microbiology Reviews, 23(4), 713-739.
Zamorano, J., Rivas, M. D. & Pérez, M. (2003). Interleukin-4: A multifunctional cytokine. Inmunología, 22(2), 215-216.
Zavros, W., Rathinavelu, S., Kao, J., Todisco, A., Del Valle, J., Weinstock, J., Low, M. J. & Merchant, J. L. (2003). Treatment of Helicobacter gastritis with IL-4 require somatostatin. Proceedings of the National Academy of Sciences USA, 100(22), 12944-12949.
Zhao, Y., Zhou, Y., Sun, Y., Yu, A., Yu, H., Li, W. Liu, Z., Zeng, J., Li, X., Chen, C. & Jia, J. (2011). Virulence factor cytotoxin-associated gene A in Helicobacter pylori is downregulated by interferon-γ in vitro. FEMS Immunology & Medical Microbiology, 61(1), 76-83.