RESUMEN
Se evaluó la genotoxicidad y la citotoxicidad en sangre periférica de ratones CD-1 expuestos a metales pesados: cromo y talio (Cr [VI] y Tl [I]). Grupos de cinco organismos fueron tratados por vía intraperitoneal con 20 mg/kg de CrO3 o con 30 mg/kg de Tl2SO4. El daño genotóxico se determinó mediante la cinética de la inducción de micronúcleos (MN) y de apoptosis, mientras que la citotoxicidad con la relación entre eritrocitos policromáticos/normocromáticos (EPC/ENC) y la viabilidad celular. Las evaluaciones se realizaron a las 0 h, 24 h, 48 h y 72 h después de los tratamientos. Los resultados mostraron un incremento significativo de MN, células apoptóticas y no-viables con ambos tratamientos. Particularmente, se presentó toxicidad celular y generalizada en los ratones expuestos al Tl2SO4. Con base en estos resultados, se sugiere que la exposición de las poblaciones humanas a compuestos metálicos, como los de Cr (VI) y Tl (I), puede representar un riesgo genético y citotóxico.
ABSTRACT
Genotoxicity and cytotoxicity were evaluated in peripheral blood of mice CD-1 exposed to heavy metals: chromium and thallium (Cr [VI] y Tl [I]). Groups of five animals were treated intraperitoneally with 20 mg/kg of CrO3 or with 30 mg/kg de Tl2SO4. The genetic damage was determined by the kinetic of micronucleus (MN) and apoptosis induction, while the cellular toxicity by the relationship between the polychromatic/normochromatic erythrocytes (EPC/ENC) and cell viability. Evaluations were performed at 0 h, 24 h, 48 h and 72 h after treatment. The results had shown a significant increment in the MN, apoptotic cells and non-viable cells with both treatments. Particularly, the cell and general toxicity was increased in mice exposed to Tl2SO4. Based on the results, it can be suggested that the exposition to metal compounds such as Cr (VI) and Tl (I) represent a genetic and cytotoxic risk for the human populations.
INTRODUCCIÓN
Las poblaciones humanas se encuentran expuestas a diversas fuentes de contaminación física, química y biológica. Dentro de los contaminantes químicos, los metales pesados son de alto riesgo, ya que además de causar severos efectos tóxicos pueden interactuar con el material genético alterando la integridad del genoma y, por consecuencia, modificar el funcionamiento celular. A pesar de que algunos metales son micronutrientes y se encuentran en los seres vivos (fierro, cadmio, zinc, arsénico, vanadio, cobre y el cromo, entre otros), la exposición prolongada o de altas concentraciones puede inducir daño genotóxico y teratógeno (Environmental Protection Agency [EPA], 2010; Flora, 2014).
Uno de los metales más estudiados es el cromo (Cr), y en particular sus compuestos hexavalentes (VI), esto es debido a que forman parte de una gran variedad de compuestos utilizados en la industria y a que tiene una asociación con la inducción de cáncer (Agency for Toxic Substances and Disease Registry [ATSDR], 2012; Haney, Erraguntla, Sielken & Valdez-Flores, 2014). Si bien, el cromo trivalente (Cr [III]) es un micronutriente esencial que juega un papel importante en el metabolismo de proteínas, azúcares y grasas (O’Brien, Ceryak & Patierno, 2003), el cromo hexavalente (Cr [VI]) puede llegar a generar Especies Reactivas de Oxígeno (ERO) y Radicales Libres (RL) durante su reducción intracelular a Cr [III], las cuales pueden interactuar con el material genético e inducir daño genotóxico. Algunos de los daños citogenéticos asociados con los compuestos de Cr [VI] son las aberraciones cromosómicas (AC) y los micronúcleos (MN) (García-Rodríguez, López-Santiago & Altamirano-Lozano, 2001; McCarroll et al., 2010; O’Brien et al., 2003). Se ha planteado que la carcinogénesis del Cr [VI] puede ser iniciada y promovida por el daño genotóxico inducido por la reducción intracelular (Gatto, Kelsh, Mai, Suh & Proctor, 2010). Por su parte, a pesar de los usos en la industria de algunos de los compuestos del talio (Tl), como el sulfato de talio (Tl2SO4), sus efectos genotóxicos y citotóxicos han sido escasamente estudiados. De hecho, la mayor parte de los estudios sobre los compuestos de talio menovalente (Tl [I]) se enfocan hacia su acción tóxica generalizada. Recientemente, se reportó que las personas que fuman, así como los fumadores pasivos, se encuentran expuestos a Tl2SO4, ya que es un componente del tabaco (ATSDR, 1992; EPA, 2009; Rodríguez-Mercado & Altamirano-Lozano, 2013). Estudios recientes realizados in vitro han mostrado que los compuestos del talio son capaces de interaccionar con el Ácido Desoxirribonucleico (ADN) e inducir citotoxicidad (Rodríguez-Mercado, Hernández-De la Cruz, Felipe-Reyes, Jaramillo-Cruz & Altamirano-Lozano, 2013), sin embargo, son escasos o nulos estudios in vivo. De ahí que en el presente estudio se expusieron ratones de la cepa Hsd:ICR (CD-1®-ratones no consanguineos ICR-Institute of Cancer Research) a compuestos metálicos tanto de Cr [VI] como de Tl [I], con el objetivo de evaluar los efectos en particular de estos dos metales sobre el material genético, así como de su toxicidad celular in vivo. Para las evaluaciones del daño genotóxico se realizó el análisis de la cinética de inducción de MN y de apoptosis, mientras que para las evaluaciones de citotoxicidad se estableció la relación entre eritrocitos policromáticos/normocromáticos (EPC/ENC) y la viabilidad celular; particularmente en este estudio se empleó una nueva técnica de biomonitoreo en células de sangre periférica (García-Rodríguez, Carvente-Júarez & Altamirano-Lozano, 2013).
MATERIALES Y MÉTODOS
Animales
Se emplearon ratones macho de la cepa CD-1, de dos a tres meses de edad (35 g-40 g), obtenidos del bioterio Harlan de la Facultad de Química de la Universidad Nacional Autónoma de México (UNAM). Los animales fueron aclimatados durante dos semanas en el bioterio de la Facultad de Estudios Superiores Zaragoza (FES-Z) de la UNAM, permitiéndoseles el libre acceso tanto al agua como al alimento (NUTRI-CUBOS, PurinaMR). Los ratones se mantuvieron bajo condiciones controladas de temperatura y circulación de aire, así como de periodos de luz-oscuridad de 12 h-12 h.
Los criterios de evaluación y condiciones de trabajo se establecieron de acuerdo con los lineamientos de la Organization for Economic Co-operation and Development (OECD-474), de la Food and Drug Administration (FDA), de la Environmental Protection Agency (EPA), del Collaborative Study Group for the Micronucleus Test (CSGMT) y del Mammalian Mutagenesis Study Group of the Environmental Society of Japan (JEMS.MMS) para ensayos de micronúcleos (MN) a corto plazo en sangre periférica de ratón (CSGMT, 1995; EPA, 1998; FDA, 2000; Heddle et al., 1983; OECD, 1997). El Comité de Bioética de la FES-Z de la UNAM aprobó los protocolos experimentales utilizados en este estudio.
Reactivos
Todos los reactivos fueron obtenidos de Sigma Chemicals Co. (St. Louis, MO, USA). Naranja de Acridina (CAS núm. 10127-02-3); Bromuro de Etidio (CAS núm. 1239-45-8); Tl2SO4 (CAS núm. 7446-18-6); CrO3 (CAS núm. 1333-82-0).
Diseño experimental
Los compuestos metálicos (Tl2SO4 y CrO3) se prepararon por separado en una solución mediante su disolución en agua destilada estéril y se administraron inmediatamente por vía intraperitoneal (i.p.) en un volumen no mayor a 0.25 ml. Se conformaron grupos al azar de cinco ratones que fueron tratados de la siguiente forma: a) Grupo testigo, se les administró únicamente el vehículo, b) Grupo CrO3, se les aplicaron 20 mg/kg de trióxido de cromo y c) Grupo Tl2SO4, se les aplicaron 30 mg/kg de sulfato de talio.
Para las evaluaciones de MN se tomaron muestras de sangre periférica (10 µl) de la vena caudal a las 0 h, 24 h, 48 h y 72 h después de los tratamientos las muestras se colocaron directamente sobre laminillas pre-tratadas con naranja de acridina (NA) preparadas de acuerdo con la técnica establecida por Hayashi, Morita, Kodama, Sofuni & Ishidate (1990). Las preparaciones se mantuvieron en la oscuridad a una temperatura aproximada de 4 °C hasta su análisis. Las evaluaciones se realizaron mediante la identificación de EPC, ENC y MN bajo un microscopio de fluorescencia (Nikon Optiphot-2) con una excitación azul (480 nm) y un filtro de barrera (515 nm-530 nm). El daño genotóxico fue cuantificado mediante el análisis de los MN en 2000 EPC por ratón. Mientras que el daño citotóxico se basó en el análisis de 1000 eritrocitos totales por ratón, en los que se estableció la relación EPC/ENC.
Las evaluaciones de la viabilidad, apoptosis y necrosis se realizaron con base en la técnica descrita por García-Rodríguez et al. (2013), en la que se emplea una tinción diferencial con naranja de acridina/bromuro de etidio (NA/BE). Las muestras de sangre periférica (100 µl) se obtuvieron de la vena caudal a las 48 h después de la administración de los tratamientos. Las evaluaciones se realizaron mediante la observación de las muestras bajo un microscopio de fluorescencia con una emisión de luz azul y un filtro de luz amarilla (Olympus Fluoled). Se evaluaron 300 células nucleadas por ratón; para la evaluación de la viabilidad se contabilizaron las células viables y no viables, mientras que para el análisis de apoptosis y necrosis se cuantificaron 300 células, en las cuales se identificaron las células apoptóticas tempranas, apoptóticas tardías y necróticas de acuerdo a la tinción y estructura de las mismas (García-Rodríguez et al., 2013).
Análisis estadístico
A los datos obtenidos en los experimentos de MN se les aplicó un análisis de varianzas (ANOVA), seguido de una prueba Tukey para determinar la significancia entre las medias de cada grupo, mediante el paquete estadístico Statistical Product and Service Solutions/Personal Computer (SPSS/PC) V18TM. Los datos obtenidos de las frecuencias de viabilidad celular, apoptosis y necrosis fueron analizados mediante la prueba de chi-cuadrada, utilizando el paquete Statistica/PC V 6.0TM (Adler, Bootman & Favor, 1998; García-Rodríguez et al., 2001). Para todos los análisis se consideró una p < 0.05 como significativo.
RESULTADOS
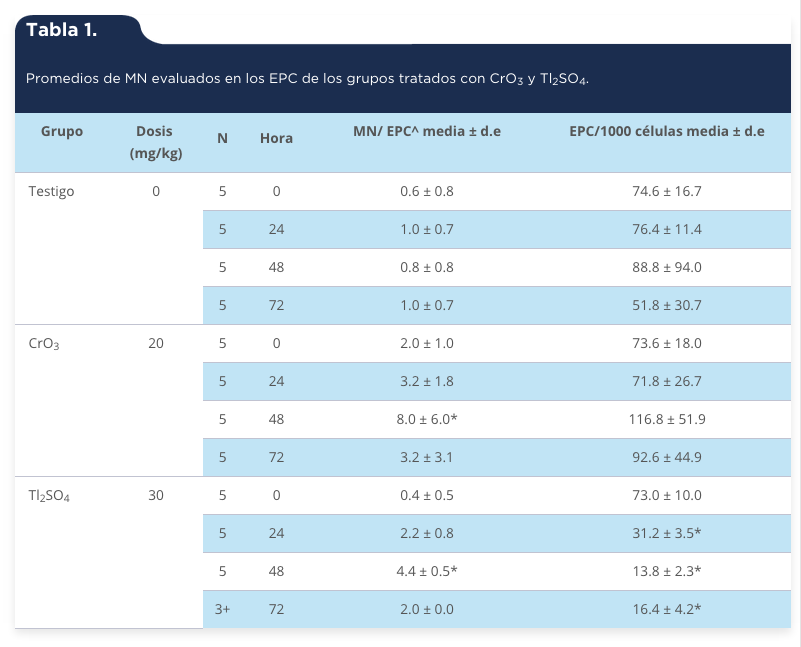
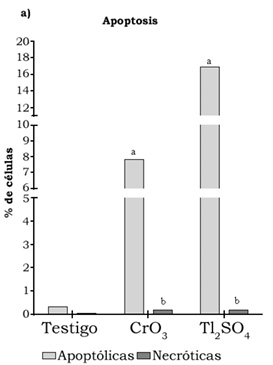
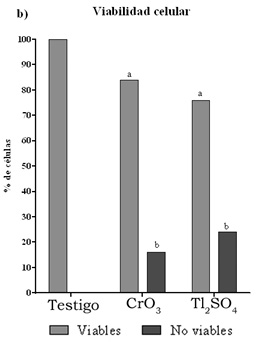
En la tabla 1 se muestran los promedios de los MN evaluados de las cero a las 72 h cuando se administraron los tratamientos de Tl2SO4 y CrO3 (30 mg/kg y 20 mg/kg por vía i.p.). Los resultados muestran que ambos tratamientos incrementan los promedios de MN, resultando estadísticamente significativos a las 48 h, además de que el CrO3 indujo el doble de MN que el Tl2SO4 (ocho y cuatro MN, respectivamente). Sin embargo, la administración del Tl2SO4 disminuyó los promedios de EPC con relación a los ENC en todos los tiempos evaluados después de la administración del tratamiento, lo cual se corrobora con el incremento de las frecuencias de células no-viables (figura 1b). Cabe resaltar que, por el contrario, en el grupo tratado con el CrO3 la frecuencia de EPC respecto a los ENC se incrementa, aunque no de forma estadísticamente significativa, pero al evaluar los porcentajes de células no-viables, éstas también presentan un aumento estadísticamente significativo con respecto al grupo testigo, aunque es menor que el efecto observado con el tratamiento de Tl2SO4 (figura 1b). Al evaluar las células apoptóticas se observa un incremento estadísticamente significativo en los porcentajes de inducción de los grupos tratados con CrO3 y Tl2SO4 (alrededor del 8% y 17%, respectivamente) resultando mayor la inducción con el tratamiento de Tl2SO4 (figura 1). De igual manera, se observó un incremento en la inducción de células necróticas con la administración de ambos tratamientos (figura 1a). Particularmente, los ratones expuestos al Tl2SO4 mostraron signos clínicos de toxicidad (pelo erizado, disminución de la movilidad y del apetito) y dos ratones murieron a las 72 h.
Tabla 1.
Promedios de MN evaluados en los EPC de los grupos tratados con CrO3 y Tl2SO4.
|
|
Grupo
|
Dosis
(mg/kg)
|
N
|
Hora
|
MN/ EPC^ media ± d.e
|
EPC/1000 células media ± d.e
|
|
Testigo
|
0
|
5
|
0
|
0.6 ± 0.8
|
74.6 ± 16.7
|
|
5
|
24
|
1.0 ± 0.7
|
76.4 ± 11.4
|
|
5
|
48
|
0.8 ± 0.8
|
88.8 ± 94.0
|
|
5
|
72
|
1.0 ± 0.7
|
51.8 ± 30.7
|
|
CrO3
|
20
|
5
|
0
|
2.0 ± 1.0
|
73.6 ± 18.0
|
|
5
|
24
|
3.2 ± 1.8
|
71.8 ± 26.7
|
|
5
|
48
|
8.0 ± 6.0*
|
116.8 ± 51.9
|
|
5
|
72
|
3.2 ± 3.1
|
92.6 ± 44.9
|
|
Tl2SO4
|
30
|
5
|
0
|
0.4 ± 0.5
|
73.0 ± 10.0
|
|
5
|
24
|
2.2 ± 0.8
|
31.2 ± 3.5*
|
|
5
|
48
|
4.4 ± 0.5*
|
13.8 ± 2.3*
|
|
3+
|
72
|
2.0 ± 0.0
|
16.4 ± 4.2*
|
* Significancia p < 0.05; ^2000 EPC por ratón; +Muerte de dos ratones.
Fuente: Elaboración propia.
Abrir
 |
* Significancia p < 0.05; ^2000 EPC por ratón; +Muerte de dos ratones.
Fuente: Elaboración propia. Close |
| |
 |
 |
|
Figura 1. Evaluaciones en células nucleadas de sangre periférica de ratones tratados con 20 mg/kg de CrO3 y 30 mg/kg de Tl2SO4. a) Porcentaje de células apoptóticas y necróticas. b) Porcentaje de células viables y no viables. Significancia: apoptosis ap < 0.0001; necrosis bp < 0.2; viables ap < 0.4; bp < 0.0002. ^300 células nucleadas por ratón.
Fuente: Elaboración propia. |
 |
 |
Figura 1. Evaluaciones en células nucleadas de sangre periférica de ratones tratados con 20 mg/kg de CrO3 y 30 mg/kg de Tl2SO4. a) Porcentaje de células apoptóticas y necróticas. b) Porcentaje de células viables y no viables. Significancia: apoptosis ap < 0.0001; necrosis bp < 0.2; viables ap < 0.4; bp < 0.0002. ^300 células nucleadas por ratón.
Fuente: Elaboración propia. Close |
DISCUSIÓN
La genotoxicidad del Cr (VI) y Tl (I) se demostró por la observación de un aumento significativo de MN a las 48 h en los grupos tratados con CrO3 y Tl2SO4 (tabla 1). Este incremento se observó claramente en todas las muestras evaluadas en comparación con el grupo testigo, y con su propia hora cero, es decir, antes de administrar los tratamientos. Estos resultados corroboran la genotoxicidad de los compuestos de Cr (VI), y en particular del CrO3 (García-Rodríguez et al., 2001; O’Brien et al., 2003; García-Rodríguez & Altamirano-Lozano, 2006), y dan evidencia de que el Tl2SO4 también presenta efectos genotóxicos in vivo mediante la inducción de MN.
Se ha establecido que los compuestos del Cr (VI)son capaces de atravesar la membrana celular y entrar a la célula a través de los canales aniónicos, donde agentes como el ascorbato, el glutatión y la cisteína lo reducen a cromo pentavalente (Cr [V]), Cr (IV) y Cr (III) (Shi & Dalal, 1992; Zhitkovich, Quievryn, Messer & Motylevich, 2002). Durante la reducción intracelular del Cr (VI) se generan ERO y RL que al interactuar con el ADN pueden inducir lesiones genéticas estructurales que pueden incluir la formación de aductos, rompimientos de cadena sencilla y doble, uniones entre ADN y proteínas, oxidación de bases nitrogenadas, producción de sitios abásicos, así como cruzamientos inter e intracatenarios (Shi & Dalal, 1992; O’Brien et al., 2003). El daño del material genético inducido por Cr (VI) también puede presentar efectos sobre la replicación y la transcripción del ADN, desregularizar los puntos de control en el ciclo celular, afectar los mecanismos de reparación del ADN y generar disrupción en las redes génicas regulatorias relacionadas con la muerte celular e inducir cáncer, ya que estos cambios genéticos/epigenéticos se relacionan con la progresión neoplásica (Zhitkovich et al., 2002; ATSDR, 2012). De ahí que se sugiera que el mecanismo de la genotoxicidad observada en el presente estudio pudiera estar relacionado con la reducción intracelular de Cr (VI) a Cr (III) y la generación de ERO y RL. Por lo tanto, la formación de MN observada en el grupo tratado con CrO3 pudiera ser el resultado de la interacción de las ERO y RL con el ADN. Sin embargo, los MN observados en los ratones expuestos al Tl2SO4 en la presente investigación deben ser inducidos por un mecanismo diferente al planteado para el cromo (VI), ya que a diferencia del Cr (VI) el Tl (I) no se reduce intracelularmente (EPA, 2009). Existen pocos estudios sobre la evaluación de daño genotóxico y citotóxico de los compuestos de Tl (I), de ahí que aún no se han planteado claramente los posibles mecanismos de inducción de daño. En la actualidad se desconoce si el talio puede interactuar y causar daño directamente al ADN nuclear, aunque algunos compuestos de Tl (I) presentan una fuerte afinidad hacia éste y, en particular, hacia la base nitrogenada guanina (Howerton, Sines, VanDerveer & Williams, 2001). Recientemente, se probó in vitro que el acetato de talio es capaz de inducir rompimientos de cadena doble del ADN, así como inducir algunos tipos de aberraciones cromosómicas (Rodríguez-Mercado et al., 2013). De ahí que se corrobora que los compuestos de Tl (I), como lo es el Tl2SO4, también pueden inducir daño genotóxico in vivo, como lo fue la inducción de MN observada en la presente investigación.
La apoptosis y la viabilidad celular se evaluaron directamente en la sangre periférica de los ratones obtenida a las 48 h después de la exposición a los tratamientos. La inducción de la apoptosis de células y la viabilidad se evaluó mediante la tinción diferencial NA/BE en células nucleadas de sangre periférica (García-Rodríguez et al., 2013). Los resultados obtenidos muestran que se incrementaron los porcentajes de células apoptóticas en ambos tratamientos en comparación con el grupo testigo, lo que corrobora el daño genético de Cr (VI) y Tl (I). Particularmente, se ha planteado que la alteración del estado oxidativo intracelular tiene un potencial para activar o sensibilizar una célula a la apoptosis, por lo que las ERO y RL generados a partir de Cr (VI) durante su reducción pueden jugar un papel importante en la vía de señalización de la apoptosis (Ye, Wang & Leonard, 1999; Hayashi, Kondo & Zhao, 2004). En el presente estudio se observó que el Tl2SO4 presenta una mayor inducción de células apoptóticas en comparación con el tratamiento del CrO3. La apoptosis, muerte celular programada, también juega un papel fundamental como un mecanismo de protección contra la carcinogénesis mediante la eliminación de las células dañadas genéticamente, por ello es de crucial importancia en un número de procesos fisiológicos y patológicos. La apoptosis se acompaña de cambios morfológicos característicos que incluyen contracción citoplasmática, formación de ampollas en la membrana plasmática, condensación o fragmentación de los núcleos y extensa degradación del ADN cromosómico (White, 1996), de ahí se sugiere que la apoptosis inducida por Tl2SO4 pudiera eliminar las células micronucleadas durante el proceso de eritropoyesis, y por ello se observó una menor inducción de MN en los organismos tratados con este compuesto.
El hecho de que los ratones tratados con Tl2SO4 mostraran signos clínicos de toxicidad (pelo erizado, disminución de la movilidad y del apetito), así como la muerte de dos ratones a las 72 h después del tratamiento, se explica por la elevada toxicidad que presenta el compuesto, la cual ya ha sido documentada (EPA, 2009). Esta misma toxicidad generalizada puede estar relacionada con la toxicidad y muerte celular observada mediante la disminución de la proporción de EPC en sangre periférica (tabla 1) y con el incremento de células nucleadas no viables (figura 1b) en los ratones tratados con el Tl2SO4. Los resultados obtenidos en la presente investigación contribuyen a ampliar la información referente a los daños genotóxicos y citotóxicos que pueden estar asociados con la exposición a compuestos metálicos, como los de Cr (VI) y Tl (I). De igual manera, con base en estos resultados se sugiere que la exposición de las poblaciones humanas a estos compuestos metálicos puede representar un riesgo genético y citotóxico.
AGRADECIMIENTOS
Este proyecto fue financiado por la Universidad Nacional Autónoma de México (UNAM), mediante la DGAPA con el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT), núm. de proyecto IN217712. El M. en C. Alejandro Gordillo Martínez participó en el presente estudio mediante su apoyo técnico.
REFERENCES
Adler, I. D., Bootman, J. & Favor, J. (1998). Recommendations for statistical designs of in vivo mutagenicity tests with regard to subsequent statistical analysis. Mutation Research, 417(1), 19-30.
Agency for Toxic Substances and Disease Registry (ATSDR) (1992). Reseña toxicológica del Talio. Atlanta, GA. EE. UU: Departamento de Salud y Servicios Humanos / Servicio de Salud Pública.
Agency for Toxic Substances and Disease Registry (ATSDR) (2012). Toxicological profile for chromium. Place Published: Retrieved february 2013 from http://www.atsdr.cdc.gov/toxprofiles/tp7.pdf
Environmental Protection Agency (EPA) (1998). Health effects test guidelines OPPTS 870.5395. Mammalian erythrocyte micronucleus test. Office of prevention. Pesticides and toxic substances (7101) EPA 712-C-98-226. Retrieved august, 2013 from http://nepis.epa.gov/Exe/ZyPDF.cgi/P100IRUF.PDF?Dockey=P100IRUF.PDF
Environmental Protection Agency (EPA) (2009). Toxicological review of thallium and compounds. In Support of Summary Information on the Integrated Risk information System (IRIS). U.S., Washington, DC.
Environmental Protection Agency (EPA) (2010). Toxicological review of hexavalent chromium. In Support of Summary Information on the Integrated Risk information System (IRIS). Washington, DC: Office of Research and Development.
Food and Drug Administration (FDA) (2000). Guidelines for reproduction studies for safety evaluations of drugs for human use. USA.: Redbook. Center for Food Safety and Applied Nutrition.
Flora, S. J. S. (2014). Metals. In Biomarkers in Toxicology (pp. 485-619). USA: Academic Press.
García-Rodríguez, M. C., López-Santiago, V. & Altamirano-Lozano, M. (2001). Effect of chlorophyllin on chromium trioxide-induced micronuclei in polychromatic erythrocytes in mouse peripheral blood. Mutation Research, 496(1-2), 145-151.
García-Rodríguez, M. C. & Altamirano-Lozano, M. (2006). Study of effects chlorophyllin on genotoxic and teratogenic damage induced by chromium (VI). Environmental and Molecular Mutagenesis, 47(6), 460.
García-Rodríguez, M. C., Carvente-Júarez, M. M. & Altamirano-Lozano, M. A. (2013). Antigenotoxic and Apoptotic Activity of Green Tea Polyphenol Extracts on Hexavalent Chromium-Induced DNA Damage in Peripheral Blood of CD-1 Mice: Analysis with Differential Acridine Orange/Ethidium Bromide Staining. Oxidative Medicine and Cellular Longevit, 2013(1), 1-9.
Gatto, N. M., Kelsh, M. A., Mai, D. H., Suh, M. & Proctor, D. M. (2010). Occupational exposure to hexavalent chromium and cancers of the gastrointestinal tract: A meta-analysis. Cancer Epidemiology, 34(4), 388-399.
Haney, J. T. Jr., Erraguntla, N., Sielken, R. L. Jr. & Valdez-Flores, C. (2014). Development of an inhalation unit risk factor for hexavalent chromium. Regulatory Toxicology and Pharmacology, 68(2), 201-211.
Hayashi, M., Morita, T., Kodama, Y., Sofuni, T. & Ishidate, M. (1990). The micronucleus assay with mouse peripheral blood reticulocytes using acridine orange-coated slides. Mutation Research, 245(4), 245-249.
Hayashi, Y., Kondo, T. & Zhao, Q. L. (2004). Signal transduction of p53-independent apoptotic pathway induced by hexavalent chromium in U937 cells. Toxicology and Applied Pharmacology, 197(2), 96-106.
Heddle, J. A., Hite, M., Kirkhart, B., Mavournin, K., MacGregor, J. T., Newell, G. W. & Salamone, M. F. (1983). The induction of micronuclei as a measure of genotoxicity: a report of the U.S. Environmental Protection Agency Gene-Tox Program. Mutation Research, 123(1), 61-118.
Howerton, S. B., Sines, C. C., VanDerveer, D. & Williams, L. D. (2001). Locating monovalent cations in the grooves of B-DNA. Biochemistry, 40(34), 10023-10031.
McCarroll, N., Keshava, N., Chen, J., Akerman, G., Kligerman, A. & Rinde, E. (2010). An evaluation of the mode of action framework for mutagenic carcinogens case study II: chromium (VI). Environmental and Molecular Mutagenesis, 51(2), 89-111.
O’Brien, T. J., Ceryak, S. & Patierno, S. R. (2003). Complexities of chromium carcinogenesis: role of cellular response, repair and recovery mechanisms. Mutation Research, 533(1-2), 3-36.
Organization for Economic Co-operation and Development (OECD) (1997). Guideline for the testing of chemicals, mammalian erythrocyte micronucleus test. Guideline 474. Retrieved december, 2013, 1997 from http://www.oecd.org/chemicalsafety/risk-assessment/1948442.pdf
Rodríguez-Mercado, J. J. & Altamirano-Lozano, M. A. (2013). Genetic toxicology of thallium: a review. Drug and Chemical Toxicology, 36(3), 369-383.
Rodríguez-Mercado, J. J., Hernández-De la Cruz, H., Felipe-Reyes, M., Jaramillo-Cruz, E. & Altamirano-Lozano, M. (2013). Evaluation of Cytogenetic and DNA Damage Caused by Thallium(I) Acetate in Human Blood Cells. Environmental Toxicology. doi: 10.1002/tox.21934.
Shi, X. & Dalal, N. S. (1992). The role of superoxide radical in chromium (VI)-generated hydroxyl radical: The Cr (VI) Haber-Weiss cycle. Archives of Biochemistry Biophysics, 292(1), 323-327.
The Collaborative Study Group for the Micronucleus Test (CSGMT) (1995). Protocol recommended by the CSGMT/JEMS.MMS for the short-term mouse peripheral blood micronucleus test. The Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan, CSGMT/JEMS.MMS. Mutagenesis, 10(3), 153-159.
White, E. (1996). Life, death and pursuit of apoptosis. Genes and Development, 10(1), 1-5.
Ye, J., Wang, S. & Leonard, S. S. (1999). Role of reactive oxygen species and p53 in chromium(VI)-induced apoptosis. Journal of Biological Chemistry, 274(49), 34974-34980.
Zhitkovich, A., Quievryn, G., Messer, J. & Motylevich, Z. (2002). Reductive activation with cysteine represents a chromium (III)-dependent pathway in the induction of genotoxicity by carcinogenic (VI). Environmental Health Perspectives Supplements, 110, 729-731.